hellobio免疫组织化学 (IHC) 实验组织准备
高质量的组织制备对于高质量的免疫组织化学结果绝对必要,因此始终值得花时间确保按照尽可能高的标准进行,以避免令人失望的结果。根据实验要求,组织可能需要新鲜使用或固定。
1 冷冻组织以供后续处理
有时需要在进一步处理或随后的固定之前冷冻组织。如果冷冻不当,可能会形成冰晶,损害细胞结构。通过正确冷冻,这将保持组织的质量,从而最大限度地提高免疫染色成功的机会。
1. 将装有异戊烷的烧杯(长烧杯中至少 500ml)在 -80°C 中或使用干冰预冷至 -42°C 至 -45°C 之间。定期监测温度以确保温度保持在这个范围内。
2. 在冰上使用干净的工具解剖组织。
3. 将纸巾放在铝箔上,并用滤纸除去多余的液体。
4. 将组织(不含铝箔)轻轻浸入异戊烷中。冷冻所需时间取决于组织样本大小,但冷冻成年大鼠大脑大约需要 5 分钟。
5. 在从异戊烷中取出组织之前,预冷镊子。将冷冻组织放入装有软纸巾的预冷管中。
6. 储存于-80°C 直至下次使用。
2 灌注固定
一般来说,当动物被灌注固定时,可以获得最佳质量的组织切片。该过程涉及先用缓冲液然后用固定剂替换血液,并且其具有高自发荧光。在尝试之前,请确保您的监管制度涵盖了这一点,并获得经验丰富的从业人员的培训。针对啮齿类动物的一般方案是:
1. 通过适当途径过量注射麻醉剂,直至动物没有脚趾捏和眨眼反射但心脏仍在跳动。
2. 打开胸腔,露出心脏,剪断右心房。将针插入左心室,并通过冰冷的 PBS(大鼠约 200ml,小鼠约 15ml)灌注,然后灌注类似体积的 4% 多聚甲醛的 PBS 溶液。
3. 取出大脑/其他器官,放入装有 4% 多聚甲醛的小瓶中,在 4°C 下放置 24 小时。
4. 将组织移入 4°C 含 30% 蔗糖的 PBS 中,直至组织沉入小瓶底部
3 浸入固定
对于小体积的组织,通常用固定剂孵育组织就足够了,而不是使用灌注固定。然而,这将导致较高的背景,因为血液不会从小毛细血管中去除。
1. 在冰上用干净的工具解剖组织。
2. 用冰冷的 PBS 短暂清洗
3. 将组织放入含 4% 多聚甲醛的 PBS 中,4°C 下放置 24 小时
4. 将组织移入 4°C 含 30% 蔗糖的 PBS 中,直至组织沉入小瓶底部
4 切片
可以在一系列机器上切割切片,最常见的是低温恒温器和冷冻切片机。机器的选择部分取决于可用性,部分取决于需要切割多厚的部分。检查可用机器的规格是否与所需的截面厚度相匹配。
对于载玻片免疫组织化学,切片可以直接切割到显微镜载玻片上,或者切割到 PBS 中,用于自由浮动免疫组织化学。
切割后,切片可以冷冻以供日后处理:
-
载玻片安装:让切片干燥后,切片可在 -20°C 至 -80°C 下保存长达一年
-
自由浮动 将切片转移至冷冻保护剂中,然后在 -20°C 下保存长达一年。

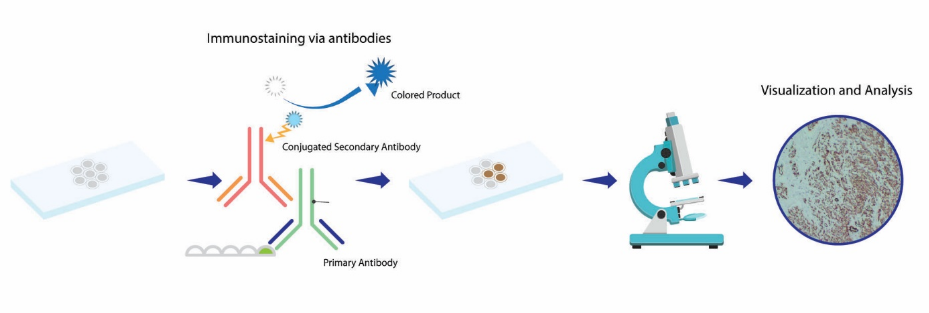
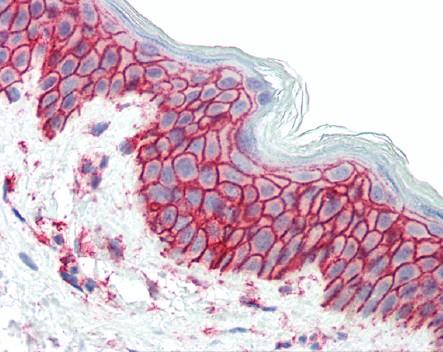 一、免疫组织化学(Immunohistochemistry,IHC)
一、免疫组织化学(Immunohistochemistry,IHC)