蛋白质印迹实验方案
裂解缓冲液:
为了准备在凝胶上运行的样品,需要裂解细胞和组织以释放感兴趣的蛋白质。这会溶解蛋白质,使它们可以单独迁移通过分离凝胶。我们使用 RIPA 缓冲液 (beyotime P0013B) 来提取全细胞提取物和膜结合蛋白。
蛋白酶和磷酸酶抑制剂:
一旦发生裂解,蛋白水解、去磷酸化和变性就开始。如果样品始终保存在冰上或 4°C 下,并且将适当的抑制剂新鲜添加到裂解缓冲液中,这些事件可以大大减慢。 Pmsf是我们经常使用的蛋白酶抑制剂。
组织裂解液的制备
用干净的工具解剖感兴趣的组织,最好在冰上,并尽可能快地防止蛋白酶降解。均质化前应将 RIPA(含 1mM pmsf)冰冷。
将组织切成小片,对于约 20 mg 的组织,将约 250 μl 裂解缓冲液快速加入管中,用电动匀浆器(或玻璃匀浆器)匀浆直至全裂解。
在微量离心机中于 4°C 下以 10000~14000g 离心 5 分钟。轻轻地从离心机中取出管子并置于冰上,吸出上清液并置于冰上保存的新管中;丢弃颗粒。
蛋白质浓度的测定:
使用 PAGE 凝胶、Bradford 测定、Lowry 测定或 BCA 测定。牛血清白蛋白(BSA)是一种常用的蛋白质标准品。
制备用于加载到凝胶中的样品:
要变性,请使用带有阴离子变性去污剂十二烷基硫酸钠 (SDS) 的上样缓冲液,并将混合物在 95-100°C 下煮沸 5 分钟。
-
清洁玻璃并设置电泳系统。
-
制备PAGE胶,根据蛋白质的分子量选择不同浓度的分离胶:
| 蛋白质大小 (kDa) | 凝胶百分比(%) |
|---|---|
| 4-40 | 20 |
| 12-45 | 15 |
| 10-70 | 12 |
| 30-100 | 10 |
| 50-200 | 8 |
-
4%堆积胶,选择预染色的蛋白质Marker Proteins的大小,以帮助区分蛋白质大小和电泳示踪剂。
-
上样跑胶,每孔加样量20-40μg蛋白,加样时注意不要溢出到相邻孔中,造成胶戳孔和交叉污染。
-
按照电泳方法推荐的说明进行电泳,当溴酚蓝将凝胶耗尽时终止凝胶电泳。
-
将蛋白质从凝胶转移到膜上。 (根据trans-blot系统推荐的说明。)
-
查看膜中的蛋白质:丽春红。转印后,用丽春红染料染色约2~5min,检查转印是否成功。然后用蒸馏水冲洗掉染料。
-
封闭膜一般用5%脱脂牛奶,或3%~5% BSA。 4 ℃摇床振荡封闭过夜,或37 ℃封闭2小时。封闭后TBS洗涤5-10秒。
-
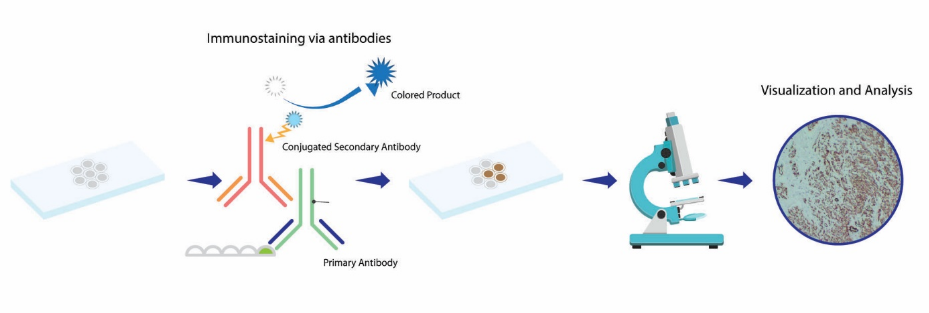
与一抗一起孵育。按照推荐的抗体稀释度,用TBST(或1%~3%脱脂牛奶)稀释抗体。然后将膜装入自封袋和固定层压机中,将抗体溶液添加到自封袋中,并确保膜与足够体积的抗体一起孵育。
-
37℃振荡孵育1~3 h(根据抗体效价和亲和力),或4℃过夜孵育,TBST室温摇床上洗3次,每次5~10 min。
-
与二抗孵育,同步骤(4),用TBST稀释,37℃振荡孵育1~3 h。
HRP 偶联抗体的化学发光、显影和固定:ECL 是使用的传统试剂盒。
在暗室中,将显影剂和固定剂分别装入塑料托盘中,在离心管中混合两种试剂(A 和 B 的体积)。确保膜表面蛋白与混合物充分接触。 1~2分钟后去除残留物。
红灯处取出胶片,打开胶片夹,将胶片放在胶片上,取下胶片夹,根据信号强度调整曝光时间,记住曝光过度的胶片不适合分析。
曝光完成后,取出胶片,迅速浸入显影液中,终止显影。显影后,应立即将胶片浸入定影液中成透明膜。用自来水清洗除去残留的固定剂后,在室温下干燥。