DNA纯化方法和流程概述?
BiteSizeBio列出了“清理 DNA 样本的 5 种方法”。在某种程度上,这个总结是过时的并且具有误导性。让我们来看看它们是如何工作的。
-
苯酚-氯仿萃取以去除蛋白质。将 DNA 溶液与苯酚和氯仿混合。水溶性 DNA 分配到水相中,而蛋白质在有机溶剂存在下变性,从而留在有机相中。
-
乙醇沉淀脱盐。在 DNA 提取中,盐通过破坏将核酸固定在一起的蛋白质链来释放 DNA 链。由于 DNA 不溶于乙醇。在乙醇溶液中,盐使 DNA 不易溶于水,同时有助于保持蛋白质(有机小分子)溶解在水中。结果是,DNA 分子聚集并从溶液中沉淀出来。
-
基于硅胶柱,使用硅胶或硅胶珠和离液盐。离液盐会破坏链之间的氢键,促进 DNA 与二氧化硅的结合以及与样品其余部分的分离。
-
阴离子交换使用带正电荷的 DEAE 功能化树脂结合带负电荷的 DNA 磷酸主链。
-
磁珠使用磁珠以 pH 依赖性方式有条件地结合 DNA,让您只需控制 pH 即可将 DNA 与样品的其余部分分离。磁珠带正电,在低 pH 条件下结合 DNA,但在高 pH 条件下,它们带负电荷,从而释放 DNA。
前两个实际上是称为有机提取的DNA 提取方法的一部分,该方法包括裂解步骤、苯酚氯仿提取、乙醇沉淀和洗涤步骤。
后 3 个用于 DNA 清理。所有步骤都包括结合、洗涤和洗脱步骤。其中基于磁珠的方法,因为不需要离心和其他耗时的处理步骤。它是高通量处理自动化的理想选择。由于它是现在的主流方法,珠子的成本在过去十年中下降了一半。
如何净化DNA?
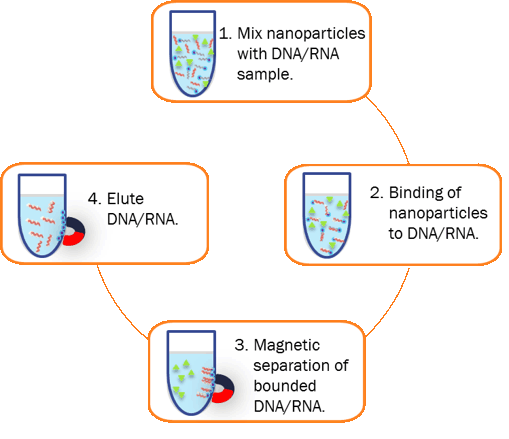
图 3. DNA 纯化工作流程。
-
混合:将纳米颗粒与 DNA 样品混合。
-
结合:当与样品混合时,纳米粒子与目标 DNA 样品结合。
-
清洗:使用磁力(例如磁力分离架)来拉动和聚集结合的材料。通过抽吸去除未结合的材料,剩下的是纳米颗粒结合的目标。
-
洗脱:从纳米颗粒中释放结合的目标样品。清洁后的 DNA 样品即可用于下游应用。
