抗体阵列的多重蛋白质检测
微阵列是一种能够同时检测多个分子(例如核酸、肽、蛋白质或抗体)的测定方法。它们被称为“微”阵列,因为分析物是在很小的表面积内测量的;例如,可以在标准载玻片(75 毫米 x 25 毫米)上分析数千个分子。这些工具在研究和临床中具有无价的价值,因为这些数据代表了某一时间点发生的生物过程的大快照。用于测量蛋白质的一种微阵列是抗体阵列。与一次仅分析一种蛋白质的“单重”测定(例如酶联免疫吸附测定)相比,抗体阵列提供了一种更实惠且更具成本效益的替代方案,且样品量要求低(ELISA)。
抗体阵列的工作原理
抗体阵列将捕获抗体固定到固体基质上,例如载玻片、膜或微珠。对于平面阵列,具有已知结合特异性的不同捕获抗体以可寻址格式点样到标准显微镜载玻片或硝酸纤维素膜上(图 1A)。对于基于珠子的阵列,捕获抗体被固定到具有不同尺寸和荧光特性的不同珠子上。由于每种特异性抗体都固定在具有特征的珠子上,因此每个珠子的蛋白质靶标是已知的。
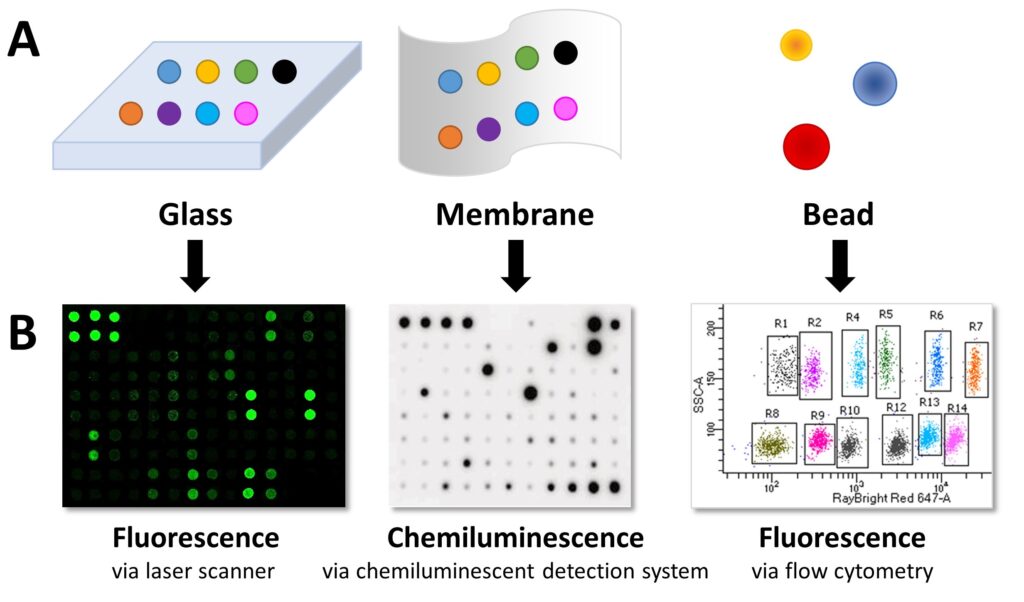
定性、半定量和定量数据
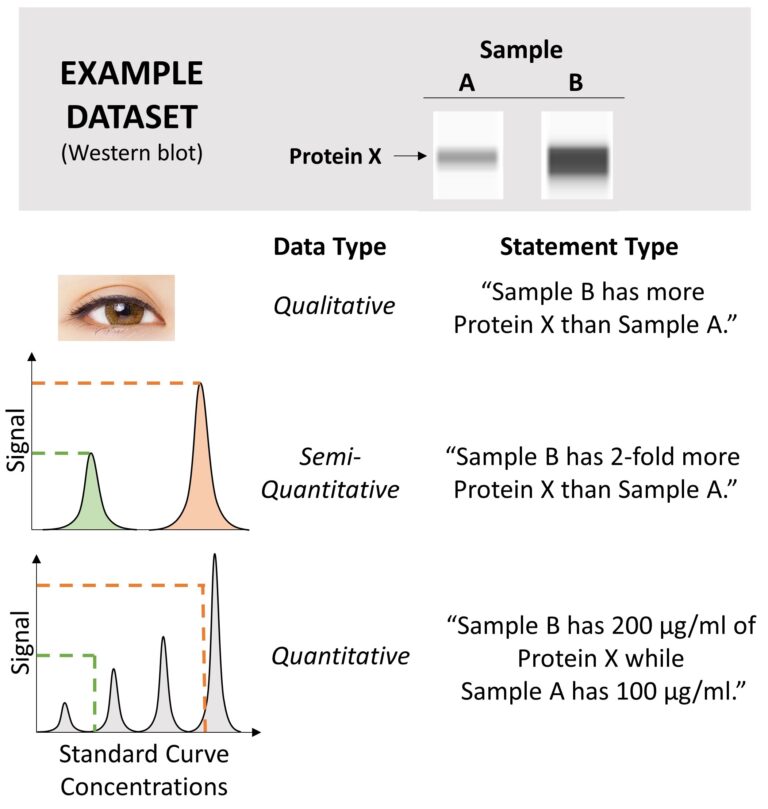
抗体阵列可以生成用于多重蛋白质检测的定性、半定量或定量数据(图 3)。定性数据的一个例子是仅通过肉眼评估的蛋白质印迹条带的强度。然而,通过定性评估很难准确估计光斑强度;因此,半定量和定量数据是优选的。
半定量和定量数据具有一定值的荧光或化学发光输出;例如,像素强度。半定量和定量数据之间的主要区别在于,定量数据具有可以与样本数据进行比较的标准曲线。可以通过半定量数据获得样品之间的相对表达差异(即倍数变化)。通过定量数据获得精确的蛋白质浓度。
数量要求
分析所需的样品量取决于样品稀释度、基质(即膜、玻璃、珠子)和设计原理(即基于标签、基于夹心)。
样品稀释
样品应至少稀释 2 倍,以避免出现称为“样品基质效应”(SME) 的现象,这是非线性稀释响应和不准确数据的常见原因。当样品中的蛋白质或其他成分影响抗体与其靶分子结合的能力时,就会发生这种情况。例如,蛋白质可能与目标分子结合,从而阻断抗体的结合位点(图 4A)。中小企业是已知和未知原因的结果。然而,通过适当的样品稀释,基质效应可以忽略不计(图 4B)。最佳稀释度会根据样品类型、实验和目标分子而有所不同;因此,在运行整个实验之前,用一些样品优化实验条件非常重要。一种可能不需要稀释的样品类型是尿液,因为它的蛋白质含量非常低。
对于血清和血浆以外的样品,样品稀释前的原始总蛋白浓度应至少为 1 mg/ml。然而,建议总蛋白浓度高于 2 mg/ml 以改善信号。这些浓度不包括可与条件培养基样品一起使用的任何血清(例如胎牛血清)。重要的是,使用浓度低于 1 mg/ml 的条件培养基样品仍可实现阵列上的高信噪比,因为上清液的蛋白质含量低于细胞和组织。个体之间血清和血浆中的蛋白质浓度范围很窄,平均总蛋白质浓度约为 70 mg/ml。
不同的细胞和组织含有不同量的蛋白质。因此,加载到阵列上的细胞、组织和样品的量必须凭经验确定。尽管如此,良好的起点是:每 100 万个细胞或 10 mg 组织使用 500 µL 裂解缓冲液,在 100 mm 组织培养板中接种约 100 万个细胞,并培养 5 天作为培养基样品。
请参阅我们的其他博客,了解有关制备用于免疫测定的细胞和组织裂解物、条件培养基样品、血清/血浆样品和尿液的更多信息。
基板及设计原理
由于膜阵列的表面积较大,因此比玻璃阵列和珠阵列需要更多的样品。然而,基于膜的阵列仍然是多重蛋白质检测的流行选择,因为它们易于操作,可以使用常见且廉价的仪器检测其化学发光,并且它们的背景噪声通常低于细胞和组织的玻璃基阵列裂解物。
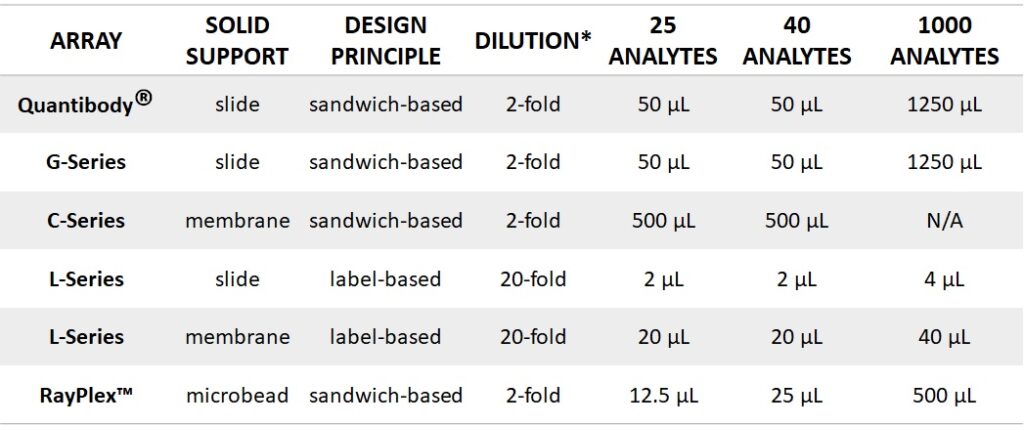
利用基于标记的阵列,每种样品蛋白质都可以与大量生物素分子结合,从而放大信号并提高灵敏度。因此,基于标签的阵列需要非常低的样本量。表 1 提供了基于阵列基质和设计原理的血清样品体积要求的比较。列出的体积未考虑移液误差或管侧面的样品损失。
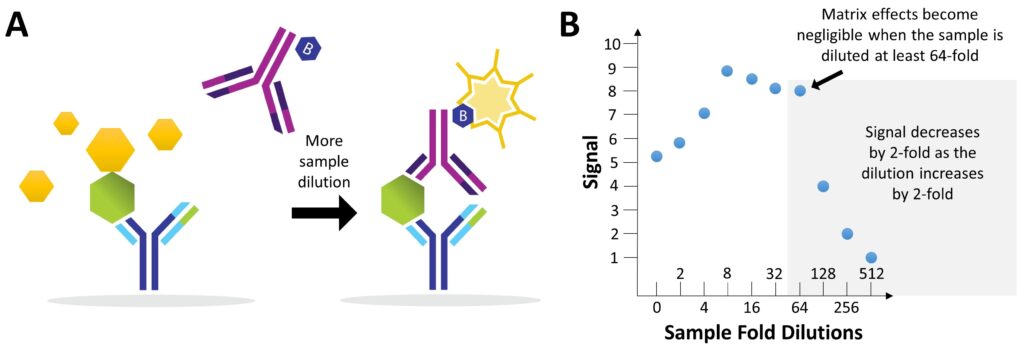
表 1. 基于固体支持物的血清体积要求和抗体阵列的设计原理
基于标签的抗体阵列与Sandwich-based的抗体阵列
基于标签的数组
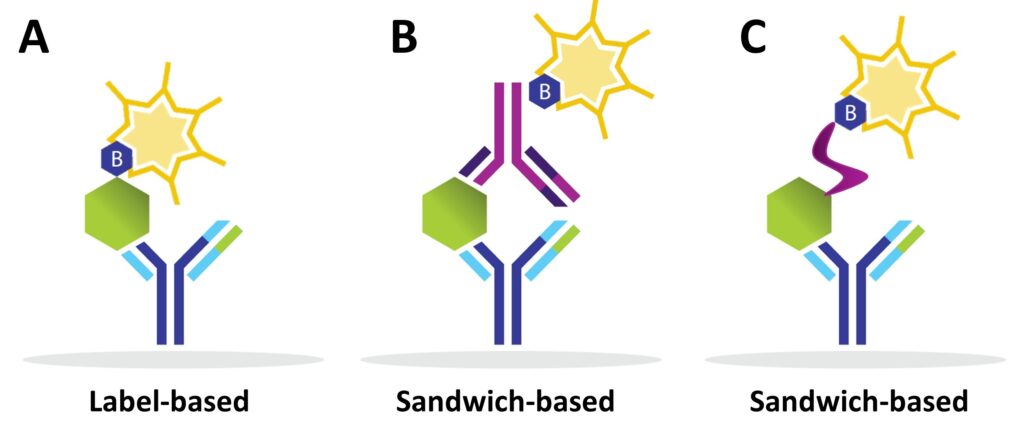
基于标记的抗体阵列每种蛋白质仅使用一种抗体:捕获抗体(图 2A)。因此,由于有大量可用抗体,非常高密度的阵列是可能的。由于抗体可以与非靶蛋白发生交叉反应,因此使用基于标记的阵列获得的任何结果都应使用正交平台(例如蛋白质印迹)进行验证。 RayBiotech 提供用于多重蛋白质检测的高密度标记阵列(L 系列),可测量多达 6,000 种人类蛋白质;第1308章 鼠类蛋白; 1500 种大鼠蛋白;或同时 500 个兔蛋白 。
基于标签的数组摘要
-
最高密度
-
特异性低于夹心阵列
-
所需样品量非常低
-
半定量数据
-
固体支撑:玻璃和膜
-
生物标志物发现的选择
Sandwich-based的阵列
基于三明治的阵列具有非常高的特异性,因为每种蛋白质需要两种不同的抗体才能检测到固定化蛋白质(图 2B)。然而,找到可以在夹心免疫测定中配对的两种抗体可能需要进行广泛的抗体筛选。抗体不仅必须与同一蛋白质上的不同区域(或表位)结合,而且表位必须易于在平台上结合。在某些情况下,两种抗体可能不会作为捕获-检测对工作,而是以检测-捕获配置工作。
RayBiotech 提供基于膜(C 系列)、珠子(RayPlex)和玻璃(G 系列、磷酸化阵列、Quantibody)基质的夹心阵列。这些阵列可以测量多达1,200 种人类蛋白质; 640 种小鼠蛋白质;或同时 67 种大鼠蛋白。使用这些阵列检测到的其他物种包括牛、犬、猫、马、猪、兔、恒河猴、鸡、海豚和绵羊。 RayPlex 和 Quantibody 阵列都提供定量数据。
Sandwich-based的阵列总结
-
低密度到高密度
-
最高特异性:每个靶标有两种抗体(即抗体对)
-
半定量和定量数据
-
固体支持物:玻璃、膜和珠子
-
临床试验和生物标志物验证的选择
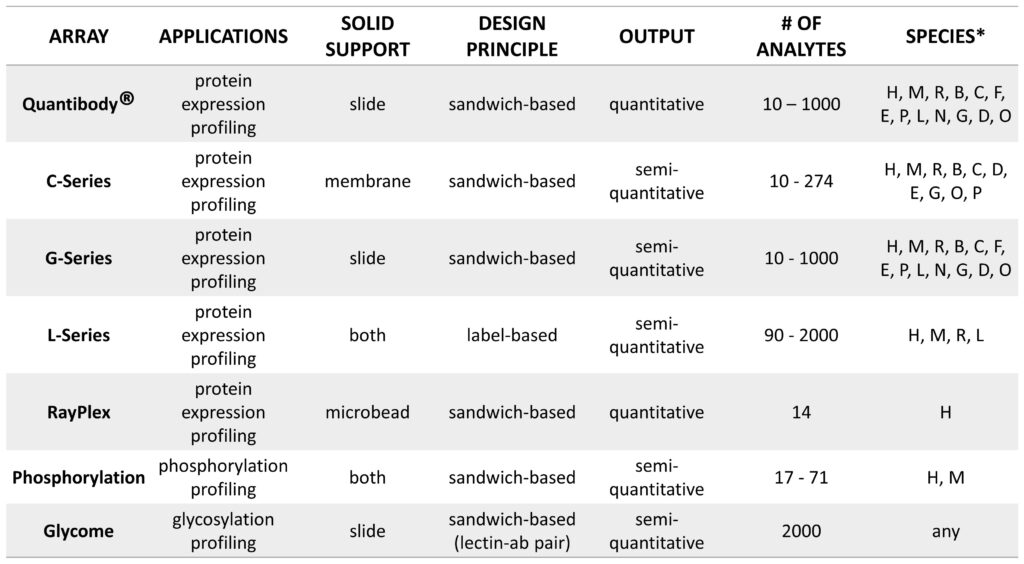
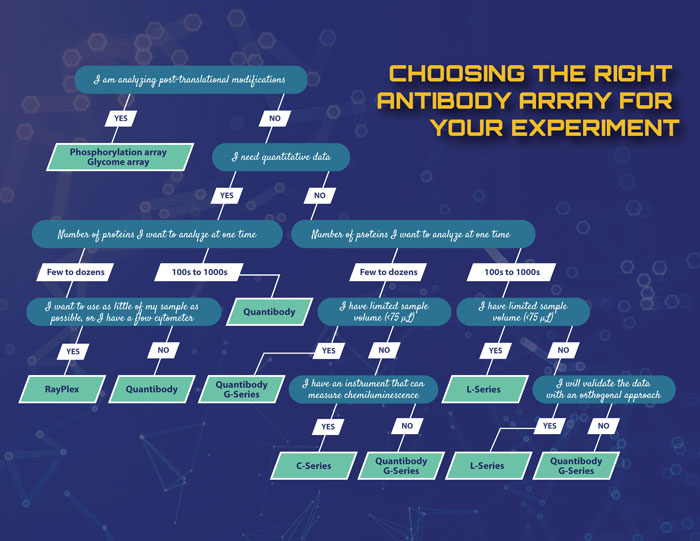
表 2 提供了 RayBiotech 提供的基于标记的抗体阵列和基于夹心的阵列的比较。图 5 描绘了帮助在多重蛋白质检测的定性、半定量或定量数据之间做出决定的决策树。
表 2. 基于标签和 Sandwich-based的抗体阵列的比较
结论
抗体阵列是一种用于蛋白质分析和多重蛋白质检测的强大技术。抗体芯片具有不同类型的格式和数据输出,可以满足不同的研究需求和能力。可同时分析数百至数千种蛋白质的高密度阵列是大规模蛋白质分析和生物标志物发现研究的理想选择。还有一些较小的小组专注于特定的生物过程或途径,例如炎症、生长因子、血管生成和肥胖。值得注意的是,抗体阵列的面板可以定制,并且可以为人员、时间或仪器有限的实验室提供完整的测试服务。
