支链两亲性阳离子寡肽与 DNA 形成肽复合物生物物理特性和转染效率的研究
支链两亲性阳离子寡肽与 DNA 形成肽复合物:其生物物理特性和转染效率的研究
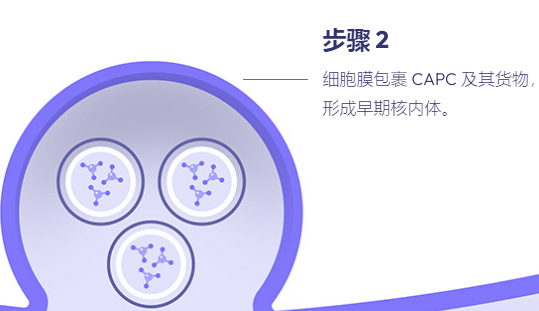
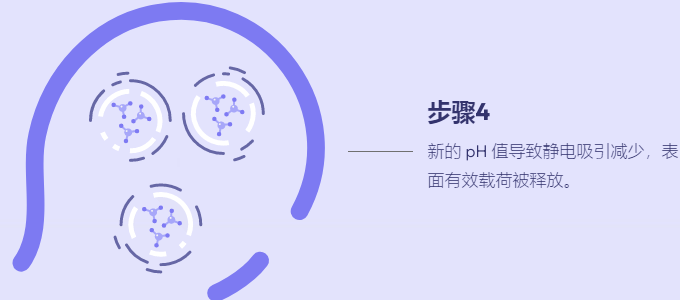
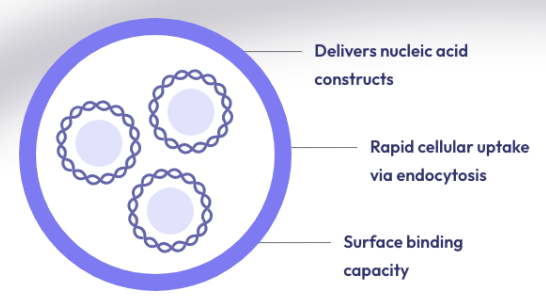
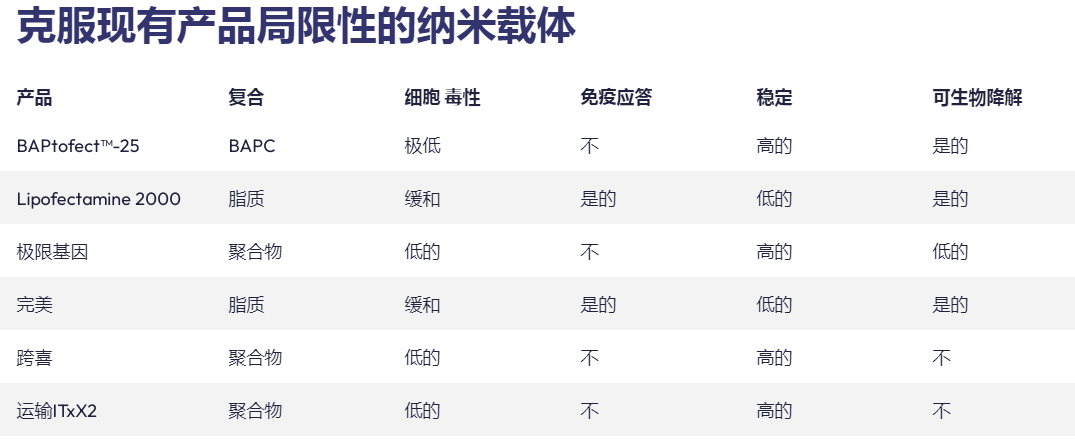
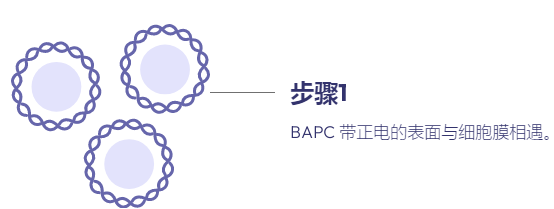
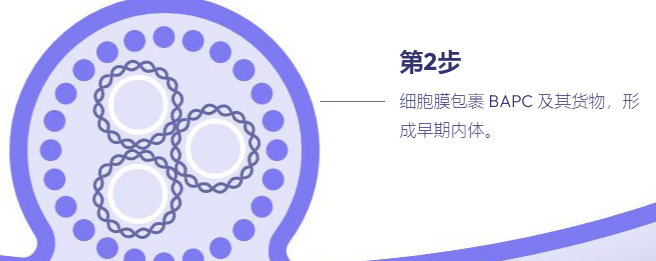
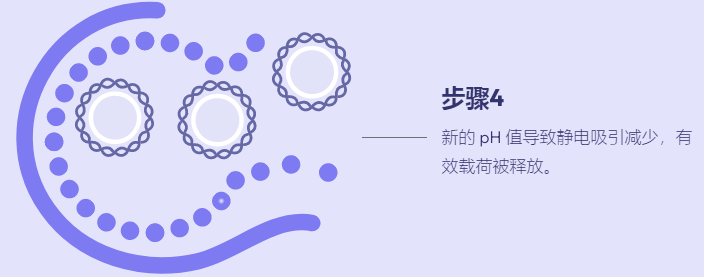
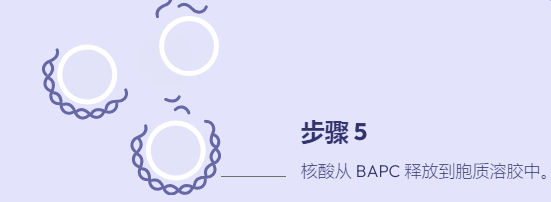
在过去十年中,肽已成为基因治疗中潜在载体的新家族。多肽易于合成且相当稳定。此外,宿主蛋白质组共享的序列预计不会具有免疫原性或引发炎症反应,而这些通常通过病毒方法观察到。我们最近报道了一类新的支链两亲肽胶囊 (BAPC),它可以自组装成极其稳定的纳米球。这些胶囊能够保留并向细胞输送 α 发射放射性核素。我们在这里报告,在双链质粒 DNA 存在的情况下,BAPC 无法形成。相反,根据肽/DNA 的比例,肽要么覆盖质粒表面形成纳米纤维(高肽与 DNA 的比例),要么将质粒压缩成纳米尺寸的压实
结构(以低肽与 DNA 的比例)。对于两种类型的组件,观察到不同的基因传递效率。紧凑的纳米尺寸结构在 HeLa 细胞中显示出更高的转染效率。当考虑到活的转染细胞总数时,这种转染水平高于脂质试剂所观察到的转染水平。