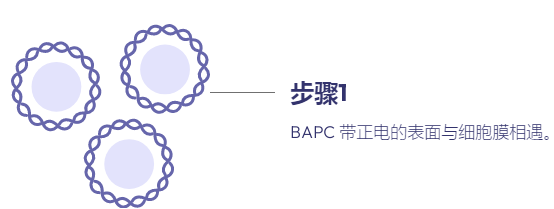
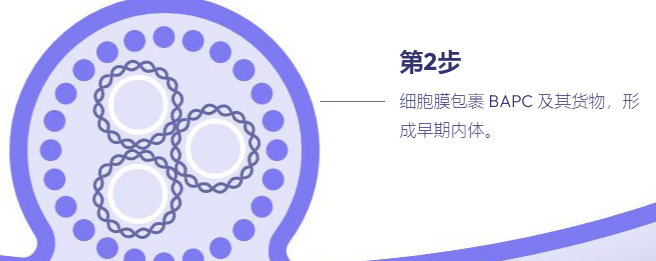
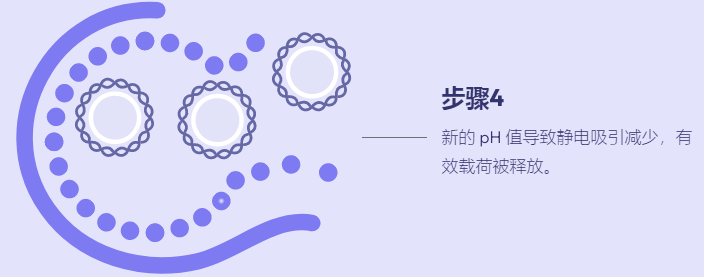
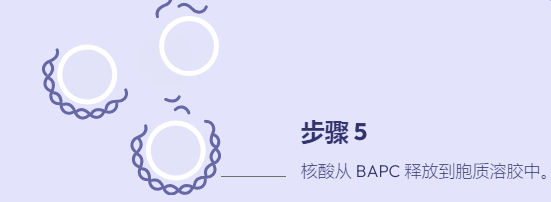
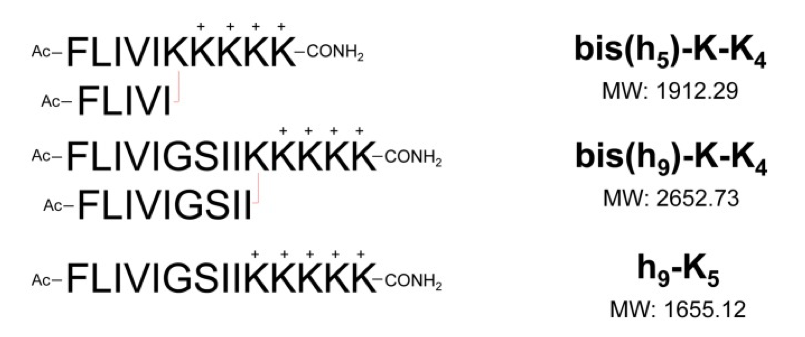溶质包封纳米颗粒用作递送系统的综述,重点是支链两亲肽胶囊
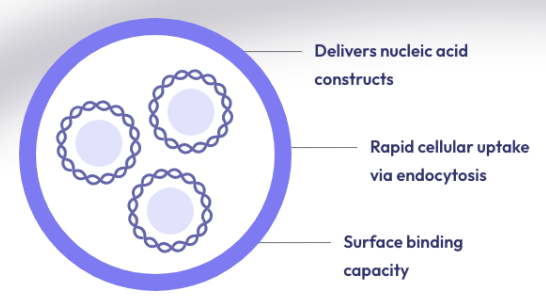
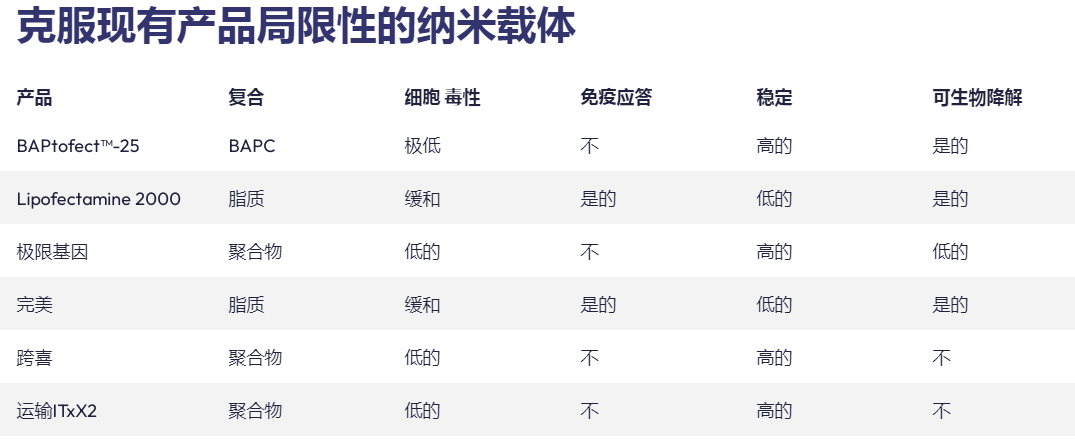
phoreusbiotech正在开发各种策略来改善药物的递送和增加药物的生物半衰期。为了解决这些问题,药物输送技术依赖于不同的纳米级分子,包括:脂质囊泡、病毒衣壳和纳米颗粒。肽是许多这些纳米材料的组成部分,并克服了与基于脂质或病毒的递送系统相关的一些限制,例如可调性、稳定性、特异性、炎症和抗原性。本综述侧重于自组装形成囊泡/胶囊的生物基药物递送纳米材料的演变。虽然脂质囊泡在这些结构中最为突出;基于肽的结构正在出现,特别是肽双层分隔胶囊。
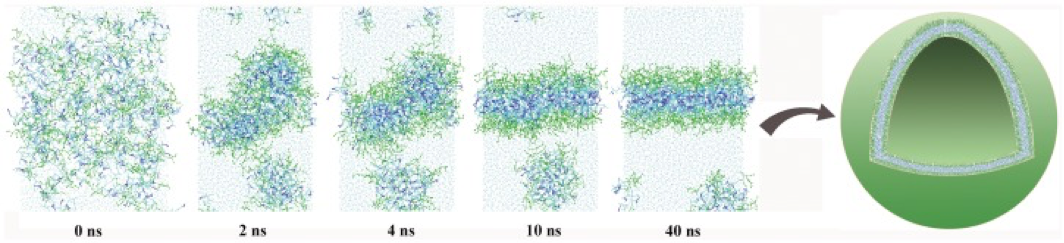
新型生物材料支化两亲肽胶囊 (BAPC) 显示出许多理想的特性。这些纳米球由两个支链肽 dbis(FLIVI)-K-KKKK 和 bis(FLIVIGSII)-K-KKKK 组成,旨在模拟分子结构中的二酰基磷酸甘油酯。它们经历超分子自组装并形成溶剂填充的双层划定胶囊,尺寸范围为 20 nm 至 2 mm,具体取决于退火温度和时间。它们能够封装不同的荧光染料、治疗药物、放射性核素甚至小蛋白质。虽然 BAPC 与脂质囊泡具有许多相同的特性,但它们更加稳健。已对它们的稳定性、大小、细胞摄取和定位、细胞内保留以及培养和体内的生物分布进行了分析。