蛋白质印迹与 ELISA:这两种测试中哪一种对于 HIV 检测最准确?
什么是酶联免疫吸附测定?
什么是蛋白质印迹?
HIV ELISA 检测如何进行?
蛋白质印迹技术在 HIV 检测中的作用是什么?
-
无法检测急性感染
-
HIV-2 感染可能被错误分类为 HIV-1 感染
-
由于需要批次或需要外包样品进行测试而导致实验室流程延迟
-
在血清转化的急性和早期阶段可能出现假阴性或不确定的结果。
-
解释结果有困难。

蛋白质印迹与 ELISA:这两种测试中哪一种对于 HIV 检测最准确?
无法检测急性感染
HIV-2 感染可能被错误分类为 HIV-1 感染
由于需要批次或需要外包样品进行测试而导致实验室流程延迟
在血清转化的急性和早期阶段可能出现假阴性或不确定的结果。
解释结果有困难。
HIV基因编辑技术介绍
用于编辑基因的 CRISPR/Cas 系统的发展正在改变基因工程。1 , 2与 HIV 感染等疾病过程相关的生物途径尤其令人感兴趣。3 HIV 通过感染和破坏免疫系统细胞,特别是对哺乳动物适应性免疫反应至关重要的 T 细胞,对免疫系统造成严重损害。不同的研究实验室开发了 CRISPR/Cas 基因编辑模型,试图减少 HIV 感染。
CRISPR/Cas最初被发现是原核适应性免疫系统的关键组成部分。 CRISPR 代表成簇规则间隔的短回文重复,它们是包含碱基 DNA 序列短重复的原核 DNA 片段。重复序列由短间隔外源 DNA 分隔开,该外源 DNA 源自原核生物(细菌和古细菌)先前暴露于质粒或噬菌体病毒。
CRISPR 与 CRISPR 相关 (CAS) 基因协调发挥作用,使原核适应性免疫系统能够识别、响应和消除外源 DNA。 CRISPR/Cas基因编辑被称为分子剪刀,因为它本质上是从原核生物基因组中剪掉外源DNA(质粒和噬菌体)。原核生物中的 CRISPR/Cas 基因编辑类似于真核生物中的 RNA 干扰或基因沉默。
原核 CRISPR/Cas 机制被用来开发一系列丰富的编辑工具,例如用于哺乳动物细胞的 CRISPR/Cas9。 CRISPR/Cas9 有两个主要组件:Cas9 和 RNA 向导,后者通过互补核苷酸结合将 Cas9 靶向特定的 DNA 片段。 Cas9 是一种核酸内切酶,通过与向导 RNA 结合,以序列特异性方式切割双链 DNA。指导 RNA 包含与目标 DNA 配对的核苷酸。
RNA 向导经过基因工程改造,可与选定的基因靶标配对,并与 Cas9 一起递送至细胞。当 RNA 引导 Cas9 到达目标基因组序列时,它允许 Cas9 在基因组中选定的目标点切割两条 DNA 链。然后可以在 Cas9 切割位点修改、插入或去除 DNA。
研究人员设计了 RNA 向导来指导 Cas9 切割含有必需基因或长末端重复序列的 HIV 病毒 DNA 的不同区域。3 CRISPR/Cas9 基因编辑可显着抑制各种研究细胞模型中的 HIV 病毒产生和感染,包括人类多能干细胞、原代 CD4+ T 细胞和 CD4+ T 细胞系。理论上,消除感染细胞中病毒表达所必需的HIV病毒DNA或基因应该能够灭活或消除HIV感染。
不幸的是,研究人员还在一些实验中发现细胞产生了 CRISPR/Cas9 抗性突变。当 Cas9 被引导切割时,这些突变聚集在病毒位点。 Cas9 无法切割目标位点,因此 CRISPR/CAS9 攻击无效。3 HIV 与其他病毒一样,具有进化出对其他攻击机制(例如人类免疫系统和抗病毒的药物)的抵抗力的能力。
在另一种对抗 HIV-1 感染的方法中,CRISPR/Cas9 已被用来消除趋化因子受体 5 型 (CCR5) 的表达。4CCR5 是一种辅助受体,某些 HIV 类型需要 CCR5 才能进入 T 细胞并引起 HIV 感染。研究人员利用靶向 CCR5 的 CRISPR/CAS9 载体破坏了 CD34 阳性造血干细胞和祖细胞中的 CCR5 基因。研究人员表明,CCR-5 突变克隆保留了分化为多种造血谱系的能力,并且很少引入脱靶突变。这很重要,因为安全性是基因编辑技术重要问题。因此,有必要证明经过编辑的细胞仍然可以发挥作用,并避免意外的、可能有害的突变。 CRISPR/CAS 系统的成功和局限性的认识都在推动优化策略。
重要的是,突变 CCR5 的策略已在使用锌指核酸酶 (ZFN) 的初步临床医学研究试验中成功进行了测试。 ZFN 与 CRISP/Cas 一样,也是有前途的基因编辑分子剪刀工具,用于减少细胞中 HIV 的表达。 ZFN 是通过将 DNA 切割核酸酶结构域与锌指 DNA 结合结构域融合而生成的。与 CRISPR/Cas 技术中使用的 RNA 向导一样,锌指结构域可以被设计为靶向特定的 DNA。含有 Fok1 限制性酶的核酸酶结构域是分子剪刀组件,可催化切割目标 DNA。 SB-728-T,也称为 CCR5-ZFN,是一种研究性基因治疗 ZFN 药物(clinicaltrials.gov:NCT01543152、NCT01252641 和 NCT01044654)。
CCR5-ZFN 的机制基于 CCR5 的基因工程修饰,使 CCR5 失去功能,细胞对 HIV 感染具有更强的抵抗力。 CCR5-ZFN 试剂是从给定个体获得的自体 T 细胞,例如 CD4+ T 细胞,通过锌指核酸酶对 CCR5 基因进行遗传修饰,然后重新引入宿主生物体。修改后的 CCR5 基因座可能消除 HIV 进入并感染 T 细胞的一个场所(CCR5 受体)。4 CCR5-ZFN/SB-728-T 用于研究以确定 CCR5 转基因细胞是否能够抵抗 HIV 感染。研究人员还渴望确定 CCR5-ZFN/SB-728-T 是否可以将自身复制到其他耐药细胞中,并通过阻止 HIV 进入细胞来恢复受感染宿主的免疫细胞功能。
MyBioSource 提供以下用于基因编辑研究用途的产品:
人趋化因子受体 5 型 (CCR5),ELISA 试剂盒(目录号 #MBS2020083)
CRISPR/Cas9,单克隆抗体(货号#MBS375383)
化脓性链球菌 CRISPR 相关蛋白 9 核酸酶,重组蛋白(目录号 #MBS140642)
HIV(人类免疫缺陷病毒)ELISA 试剂盒(货号#MBS766122)
HIV-2 gp39,单克隆抗体(货号#MBS430025)
HIV Gp41/gg36,重组蛋白(货号#MBS319756)
HIV-1 p24,单克隆抗体(货号#MBS8241470)
HIV-1 Tat 相互作用蛋白 2 单克隆抗体 ELISA 试剂盒(产品目录号 #MBS732587)
在基因治疗中广泛应用的逆转录病毒载体存在的主要问题,是无法高效转导非分裂期细胞,而腺病毒载体虽然能转导非分裂期细胞,但在体内不能实现目的基因稳定的长期表达,且反复应用容易引起免疫反应。慢病毒载体不但可以感染非分裂期细胞,还具有容纳外源性目的基因片段大、稳定整合持久表达、免疫反应小等优点。市场上的慢病毒是由人类免疫缺陷病毒(HIV),通过去除env、vif、vpr、vpu等毒性基因改造而来。复制缺陷型HIV载体通常用水泡口炎病毒G糖蛋白来代替HIV-1的包膜进行包装,从而更安全,宿主范围更广,还能增加病毒的滴度。
慢病毒载体的发展经历了3个阶段:第一代慢病毒载体系统是以三质粒系统为代表。在构建时把HIV-1基因组中进行包装、逆转绿和整合所需的顺式作用元件与编码反式作用蛋白的序列分离,分别构建在三个独立的质粒表达系统上,即包装质粒(一个强启动子如CMV作用下,控制除env以外所有病毒结构基因的表达)、包膜质粒(包含VSV-G基因)和载体质粒(包含目的基因),用这三种质粒共同转染包装细胞如人胚肾293T细胞,在细胞上清中即可收获只有一次感染能力、而无复制能力的慢病毒颗粒。第二代慢病毒载体系统从安全性角度又删去了HIV的所有附属基因。第三代慢病毒载体又进一步做了些安全方面的改进,如删除了U3区的3′LTR和tat基因。
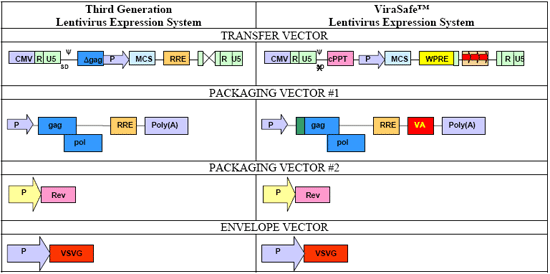
安全性始终是大家关心的问题,毕竟是HIV改造过来的,不容许有一点闪失。国内的实验室很多都达不到P2的级别,甚至是一堆人挤在一个房间里做各种各样的实验。Cell BioLabs的新一代慢病毒表达系统对广泛应用的第三代慢病毒进行了改进,将Rev与gag和pol基因分离,这意味着要产生原始的病毒,还需要更多的重组步骤。这样完整的ViraSafe™ 慢病毒表达系统包含5个载体(包括一个对照载体),安全性更高。
慢病毒的表达流程一般如下:将目的基因片段克隆到表达载体上;将重组表达载体,与包装混合物(通常是几个质粒的混合物)共转染293细胞;收集病毒上清,测定滴度;感染目的细胞,瞬时表达目的蛋白或用抗生素筛选稳定细胞株;分析目的蛋白。看上去并不复杂,但中间许多步骤需要不断优化。而且慢病毒有一个软肋,就是病毒滴度不高。你可能还需要纯化或浓缩,才能得到108TU/ml的慢病毒。
与目前市场上流行的新一代慢病毒相比,ViraSafe™ 慢病毒表达系统进行了进一步的优化。如在载体质粒上插入了cPPT(增加基因表达水平)及WPRE(增加感染滴度),在一个包装载体中插入腺病毒VA基因以增加感染滴度;同时在整个系统载体的多个部分做了一些基因的优化或删减和插入以增加病毒的安全性。经过这样的优化,ViraSafe™ 最新一代慢病毒表达系统的包装容量增大到10kb,在应用上更广泛;其感染细胞的滴度及外源基因的表达水平均提高,这也在一定程度上弥补了慢病毒在基因治疗领域内的不足;由于对整个慢病毒系统的多层面改造,降低了载体间的同源率和重组机率,更安全。如果您的实验需要长期稳定的基因表达或沉默,而目的细胞又很难转染,那ViraSafe™ 慢病毒表达系统将是您的最理想选择。
| 产品名称 | 货号 | 产品说明 |
| ViraSafe™ Universal Lentiviral Expression System | VPK-211-ECO | 通用慢病毒表达系统,MCS位点前无启动子,克隆时可插入特异性启动子序列,分双嗜和多嗜两种 |
| VPK-211-PAN | ||
| ViraSafe™ Lentivirus Expression System (Puro) | VPK-212-ECO | EF-1α真核细胞启动子类型,带有Puro抗性筛选标记,分双嗜和多嗜两种 |
| VPK-212-PAN | ||
| ViraSafe™ Lentivirus Expression System (Neo) | VPK-213-ECO | EF-1α真核细胞启动子类型,带有Neo抗性筛选标记,分双嗜和多嗜两种 |
| VPK-213-PAN | ||
| ViraSafe™ Lentivirus Expression System (Hygro) | VPK-214-ECO | EF-1α真核细胞启动子类型,带有Hygro抗性筛选标记,分双嗜和多嗜两种 |
| VPK-214-PAN |
另外,根据您实验的不同需求,ViraSafe™ 设计出不同的启动子类型供您选择。有不含有启动子的通用型慢病毒表达载体,您可以用来表达特异性启动子引导的基因;还有真核基因强力启动子CMV启动子类型以及用于表达shRNA的RNAi以及miRNA的启动子供您选择。
美国著名细胞学试剂专家Cell BioLabs为您提供全套的慢病毒技术解决方案,ViraSafe™ 慢病毒表达系统有多种样式供您选择;专门针对慢病毒滴度低的软肋而专门设计的ViraBind™慢病毒浓缩&纯化试剂盒,能让你获得更高滴度和纯度的慢病毒;还有多种慢病毒快速定量以及感染滴度滴定检测方案;Cell BioLabs还有转为慢病毒载体用的293LTV细胞及高效转染试剂供您选择,如果您对慢病毒产品感兴趣,请致电021-50837765到上海金畔生物科技有限公司垂询慢病毒相关的实验解决方案,或索取最新的Cell BioLabs产品资料。