因克隆中的差异培养基是什么以及它如何工作
差异培养基是含有能够在视觉上区分生长在其上的微生物的化合物的培养基。这些培养基利用微生物的代谢和生化能力,导致外观发生明显变化。
差异化培养基通常包含指示剂,例如染料、pH 指示剂或可以被某些微生物代谢但不能被其他微生物代谢的特定底物。这些指示剂的存在或不存在或由此产生的颜色变化有助于辨别不同的微生物群或识别特定的代谢活动。
例如,使用含有 X-gal 的差异培养基进行蓝白斑筛选,通过鉴定具有所需遗传构建体的菌落来促进基因克隆。
选择性培养基和差异培养基之间的差异与每种培养基如何用于筛选转化细胞有关。选择性培养基根据生长情况筛选细胞,而差异培养基根据外观筛选细胞。
选择性培养基和差异培养基都可以帮助您决定在克隆过程中继续使用哪些菌落。
使用选择性培养基,不需要的细胞无法存活。因此,选择是基于增长的。
介导所需细胞和不需要细胞之间的分化的典型化合物是抗生素。
所需的细胞对这种抗生素具有抗性,即使在该抗生素存在的情况下也能生长。然而,不需要的细胞对抗生素敏感并且无法存活。
使用差异培养基,所需的和不需要的细胞都会生长,但可以根据集落的视觉特征来区分和筛选它们。
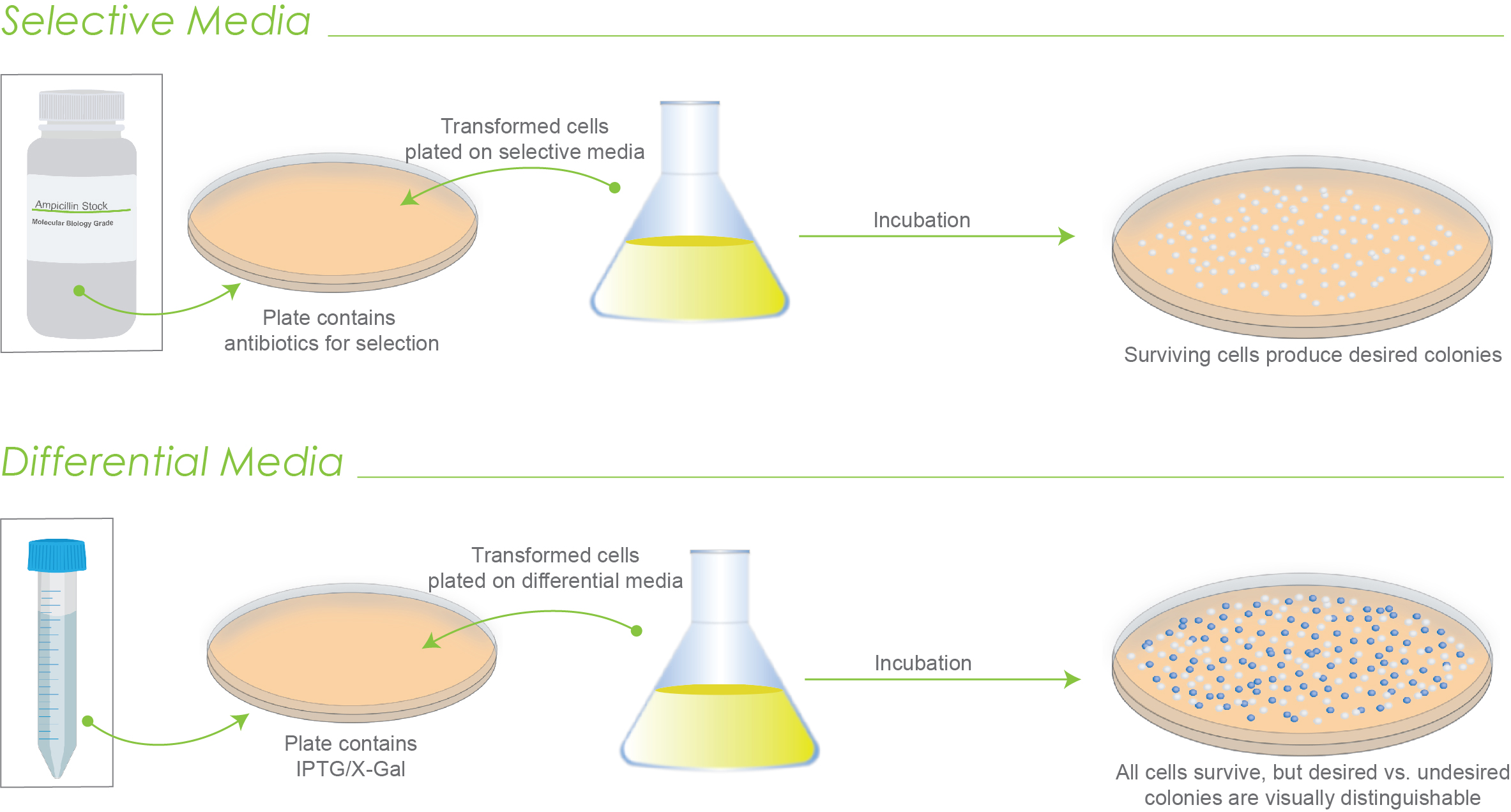
图 1.选择性媒体的工作原理与差异媒体的工作原理的图示。只有幸存的菌落才能在选择性培养基上生长。使用差异培养基,所有菌落都会生长,但可以被识别。
差异培养基的工作原理是它们含有特定酶的底物。
底物一旦被这种酶分解,就会产生有色产物。肉眼很容易发现颜色差异。
图一的差异培养基示例显示了结果中的这种颜色差异,其中白色菌落是所需菌落,而蓝色菌落不是。
为了更深入地了解这一点,请查看图 2,它演示了其工作原理。
您添加某种化合物(白色),我们在固体培养基板中将其称为化合物 C。当化合物 C 被特定的酶(我们称之为酶 E)分解时,产物是蓝色化合物。
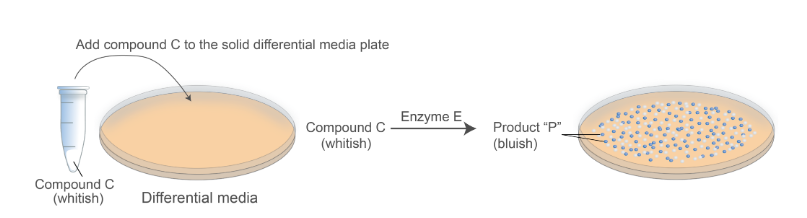
图 2.差分媒体工作原理的概念表示。
现在,在这个特定的示例中,您设计的基因构建体使得具有所需基因构建体的细胞将产生酶 E。因此,一旦它们在平板上生长,它们的集落就会呈蓝色。
另一方面,不需要的菌落——没有所需基因构建的菌落不会产生酶 E,并且它们的菌落将是白色的。

图 3.带有蓝色和白色菌落的平板照片。
在大多数克隆实验中,具有所需基因构建体的菌落是白色的,不需要的菌落是蓝色的。
这是通过称为 α 互补(α-complementation)的概念来实现的——大多数克隆宿主菌株(例如DH5-α)的一个特征。
由于本文是为了说明差异培养基在基因克隆过程中如何发挥作用,因此我们不会过多讨论蓝白斑筛选背后的分子遗传学。
为此,我们建议您查看这篇文章,其中我们详细说明了蓝白斑筛选的概念。
同样,蓝白斑筛选相关的实验方案请参考这篇文档。
然而,为了正确理解差异媒体的概念,这里简要描述了蓝白斑筛选过程中发生的情况。
β-半乳糖苷酶是蓝白斑筛选的核心。 β-半乳糖苷酶由lacZ基因作为lac操纵子的一部分合成,β-半乳糖苷酶分解乳糖。
DH5-α 等克隆宿主菌株编码 β-半乳糖苷酶的突变形式,其中氨基末端的氨基酸 11-41 被删除。这种突变型 β-半乳糖苷酶被称为ω-肽,它不能单独分解乳糖或全功能 β-半乳糖苷酶(例如 X-gal)的其他底物。
同时,相应的克隆载体如pUC19在多克隆位点编码一种称为LacZ-α或α-肽的多肽。 LacZ-α / α-肽组成 β-半乳糖苷酶的 59 个氨基酸。
当宿主菌株的基因组表达ω-肽并且载体表达α-肽时,形成功能齐全的β-半乳糖苷酶,可以分解乳糖或其类似物。这称为α-互补。
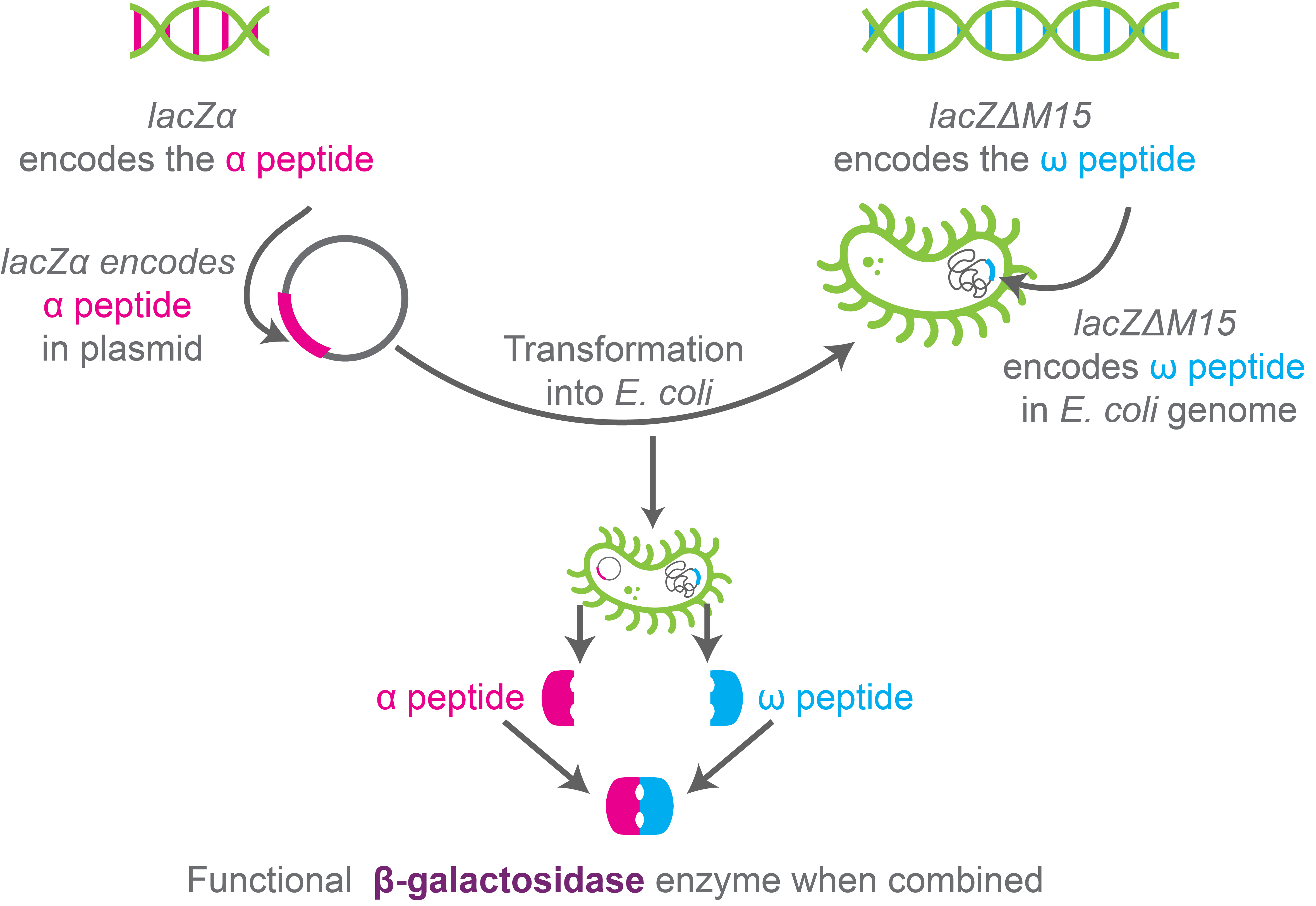
图 4. α-互补示意图。
因此,当带有克隆载体的宿主细胞接种在含有 X-gal 的培养基上时,表现出 α-互补的集落会产生功能性 β-半乳糖苷酶,分解 X-gal,形成蓝色产物。结果,菌落呈蓝色。
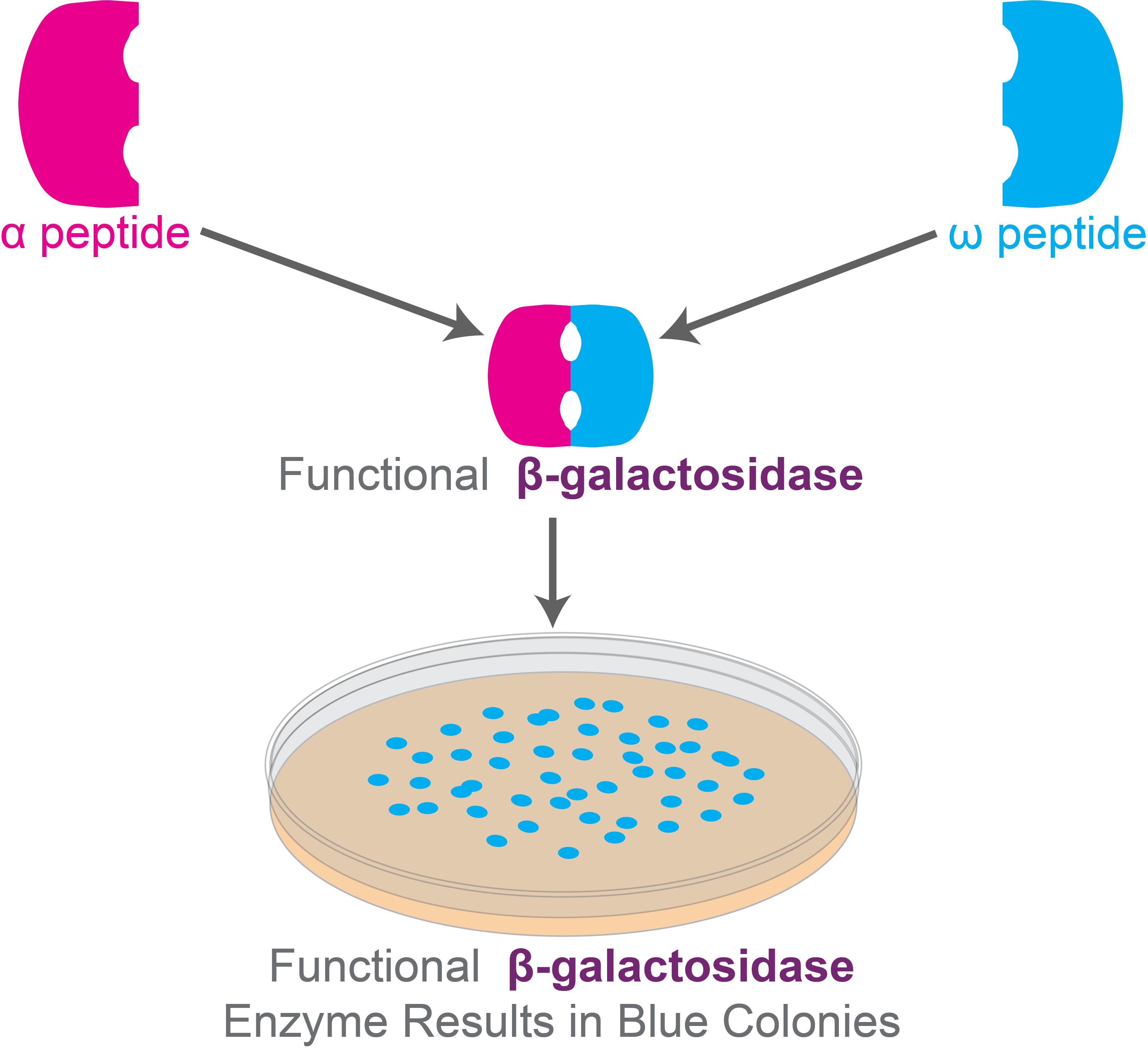 图 5.功能性 β-半乳糖苷酶在含有 X-gal 的培养基中形成蓝色菌落,用于蓝白斑筛选实验。
图 5.功能性 β-半乳糖苷酶在含有 X-gal 的培养基中形成蓝色菌落,用于蓝白斑筛选实验。
另一方面,不具有克隆载体表达的α-肽的宿主细胞不会表现出α-互补,并且不会产生功能性β-半乳糖苷酶。因此,X-gal不会被这些细胞分解。他们的殖民地将是白色的。
请注意,α-肽的基因位于克隆载体的多克隆位点 (MCS)。因此,如果载体为空白,即 MCS 内没有克隆转基因,则仍会产生 α 肽。在此,将发生 α-互补,并且由于 X-gal 被功能性 β-半乳糖苷酶分解,集落呈蓝色。
如果载体在其 MCS 内克隆了转基因,则转基因会破坏 α 肽的基因。该基因被破坏的结果是没有产生功能性的β-半乳糖苷酶,并且X-gal不会被这些细胞分解。

图 6.由于基因插入而破坏的lacZα序列不编码 α 肽。
这就是为什么平板上 所需的菌落会是白色的——编码 α 肽的基因被目标转基因破坏,这正是我们想要的。
因此,在这种情况下,只需查看集落,您就可以轻松辨别哪些细胞具有空白质粒(它们是蓝色的),哪些集落具有转基因插入片段(这些集落是白色的)。

图 7.示意图显示了在蓝白斑筛选实验中如何区分具有带插入基因的质粒的菌落和不具有插入基因的菌落。
虽然这是在基因构建体克隆过程中使用蓝白斑筛选的常见方法,但还有另一种蓝白斑筛选方法。
这里,蓝色菌落代表具有必要构建体的菌落,白色菌落不具有该构建体。
这是当遗传构建体被克隆到宿主菌株的基因组中而不是我们上面讨论的方式的克隆载体中时。
查看图 8 中绘制的结构。
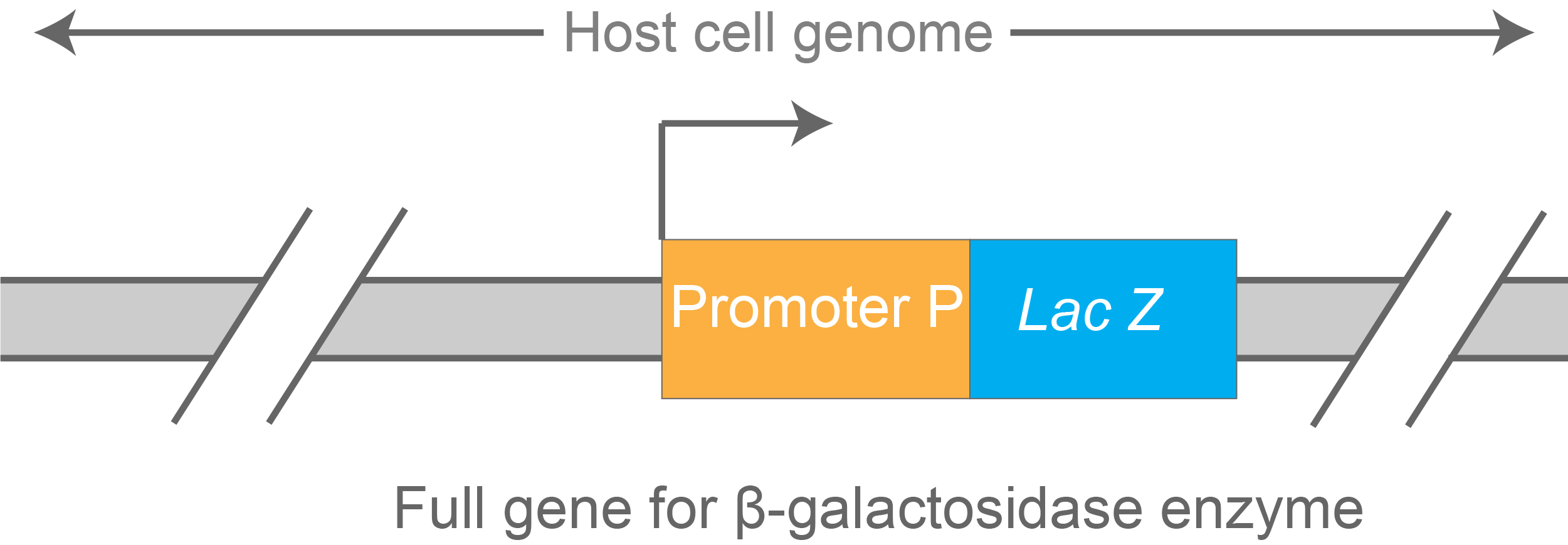
图8.克隆到宿主菌株基因组中的基于LacZ的转录报告基因构建体。
该构建体描述了测量启动子 P转录效率的报告基因。该启动子越强, lacZ转录的水平就越高,最终细胞合成的 β-半乳糖苷酶的水平就越高。
因此,β-半乳糖苷酶活性可用作测量该启动子强度的读数。
这些类型的报告基因广泛应用于分子生物学。
在此类构建体的基因工程过程中采用蓝白斑筛选。 X-gal 平板上显示为蓝色的菌落的基因组中含有该构建体。它们就是我们想要的殖民地。白色菌落的基因组中没有该构建体;他们是不受欢迎的殖民地。
一旦制备出所需菌株并使用差异培养基通过蓝白斑筛选进行筛选,下一步将测试启动子强度。
为此,测试菌株和对照菌株在液体培养物中培养至相等的细胞密度,然后使用米勒测定法测量β-半乳糖苷酶活性。
该测定的结果用作测量 lacZ 融合的启动子强度的读数(如上图 8 所示)。通过观察更多相应的β-半乳糖苷酶活性来指示启动子强度越高。
这里需要注意的是,差异培养基和蓝白斑筛选用于筛选具有必要遗传构建体的菌落,但在实际酶测定中则不然,在实际酶测定中,实验者使用不同的 β-半乳糖苷酶底物 – 例如 ONPG(2 -硝基苯基-β-D-吡喃半乳糖苷)。
红白筛选培养基
红白斑筛选在理论上和技术上与蓝白斑筛选相同。
然而,β-半乳糖苷酶的底物化合物不是 X-gal,而是添加到培养基中的品红色-gal。品红半乳糖被β-半乳糖苷酶分解后形成的产物呈红色。
因此,根据菌落是否产生功能性 β-半乳糖苷酶,它们会是红色或白色。
与蓝白斑筛选非常相似,红白斑筛选用于基因克隆过程中,以检查哪些集落克隆了必要的基因构建体。







