间充质干细胞抑制 CAR-T 杀伤淋巴瘤细胞的功效
标签归档:car
干细胞在癌症的发展和治疗抵抗中发挥着关键作用。尽管间充质干细胞 (MSC) 可以主动迁移到肿瘤部位,但它们对嵌合抗原受体修饰 T 细胞 (CAR-T) 免疫治疗的影响却很少得到解决。使用包括淋巴瘤细胞和巨噬细胞的体外细胞共培养模型,我们在此报告,在 MSC 存在的情况下,CAR-T 细胞介导的细胞毒性被显着抑制。 MSC 导致 CD4 + T 细胞和 Treg 细胞增加,但 CD8 +减少T细胞。此外,间充质干细胞刺激吲哚胺2,3-双加氧酶和程序性细胞死亡配体1的表达,这有助于肿瘤的免疫抑制功能。此外,MSC 通过调节线粒体活性氧释放来抑制 NLRP3 炎症小体的关键成分。有趣的是,如果在 MSC 中敲低编码糖蛋白激素 STC-1 的斯钙素-1 (STC1) 基因,所有这些阻碍 CAR-T 功效的抑制事件都可以被消除。使用异种移植小鼠,我们证实体内的CAR-T功能也可以被MSC抑制,其中STC1发挥了关键作用。这些数据揭示了 MSC 和 STC-1 在抑制 CAR-T 功效方面的新功能,这应该在癌症治疗中考虑,并且在控制过度免疫反应引起的毒性方面也可能具有潜在的应用。
CAR-T 细胞疗法简介
CAR-T 细胞疗法简介
CAR-T细胞的结构
CAR-T细胞疗法是传统抗癌疗法的新兴替代疗法。多年来,这些修饰细胞已表现出有希望的治疗功效,从而引起了该领域的研究的兴趣。尽管 CAR 很复杂且发展迅速,但它仍然保持着相同的模块化结构,这使得它们首先取得了如此成功。了解这些组件是设计成功的 CAR-T 平台的第一步。
嵌合抗原受体 (CAR)-T 细胞已成为治疗恶性癌症的传统放疗、化疗和免疫疗法的有希望的替代方案。 CAR 是一种工程化受体,旨在调节 T 细胞受体 (TCR),由四个主要部分组成:(i) 细胞外靶抗原结合结构域、(ii)铰链或间隔区、(iii)跨膜结构域和 (iv) 一个或几个细胞内信号传导域。这些合成结构域随后被包装到病毒载体中并转导到 T 细胞中,在那里它们将免疫反应重定向到恶性细胞。
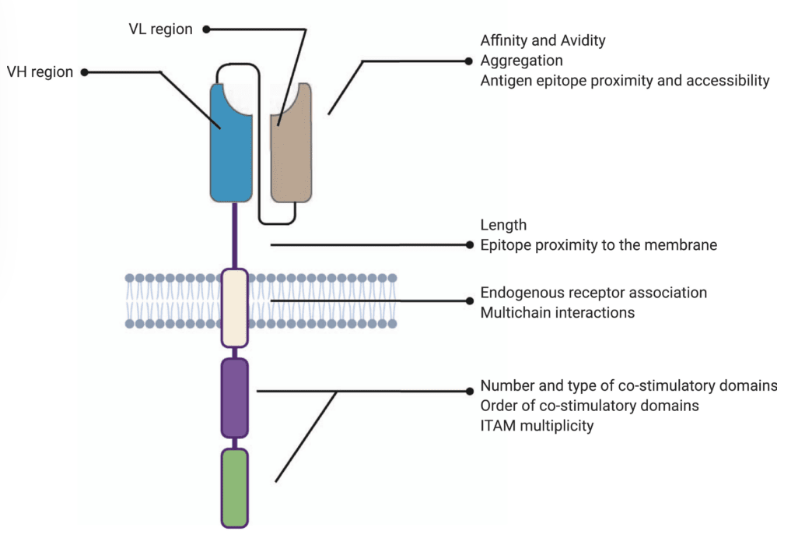
掺入 T 细胞膜中的嵌合抗原受体 (CAR) 的结构。
临床试验引起了科学界的关注,并激发了人们对 CAR 研究和开发的兴趣。因此,CAR 设计自诞生以来已经发生了巨大的发展,但其总体结构经受住了多次试验,并继续为 T 细胞疗法的开发提供有效的框架。
抗原结合域
与传统抗体类似,抗原结合域赋予 CAR 靶点特异性。因此,该结构域还决定了 CAR-T 细胞疗法的亲和力和亲和力,从而影响其疗效。传统上,CAR 的这一组件源自单克隆抗体的可变重链 (V H ) 和轻链 (VL ),通过接头结合形成单链可变片段 (scFv)。
这些 scFv 通常靶向癌细胞的膜结合表面受体,并导致主要组织相容性复合物 (MHC) 独立的 T 细胞激活。由于其在细胞激活中的作用,抗原亲和力必须足够高和选择性,但不足以诱导表达 CAR 的 T 细胞死亡。此外,研究还表明,对同一靶标具有相似亲和力的 CAR-T 细胞可能会导致截然不同的临床结果。这些差异可以通过癌细胞表面的表位位置和抗原密度等因素来解释。
抗原结合域开发的另一个重要考虑因素是scFv 聚集。 scFv 在强直信号传导(即以不依赖于抗原的方式进行信号传导)中发挥重要作用,因此,它们的过度聚集可导致高强直信号传导和随后的 T 细胞早期耗尽。聚集可能是由低折叠稳定性或 V H -V L界面处暴露的疏水残基引起的。限制这种效应使我开始对 T 细胞中 CAR 的表达水平进行精细控制。
简而言之,CAR-T细胞的最佳治疗效率始于在亲和力、表位特异性和CAR表达水平方面实现平衡。这反过来又凸显了在开发早期阶段需要进行广泛的 scFv 表征和工程设计。
铰链区
铰链区或间隔区是 CAR 的胞外结构,从抗原结合域延伸至跨膜域。该区域为 scFv 提供了灵活性,可用于增强对空间上无法接近的区域中目标表位的识别。
铰链设计,即长度和组成,也会影响 CAR 表达、信号传导和强度激活输出。最佳间隔长度取决于靶表位的位置和靶细胞上的空间位阻水平。例如,大量研究表明,长间隔区可以更好地接近近膜表位或糖基化抗原。相反,当靶向膜远端表位时,短铰链更有用。但实际上,间隔区长度需要针对每个特定的配体-scFv 对进行定制。与 scFv 对特定抗原的亲和力类似,长间隔区可以产生特别强烈的体内反应,但也会导致激活诱导的细胞死亡。
常用的铰链区源自膜结合受体(CD8 或 CD28)或 IgG(IgG1 或 IgG4)。然而,已知 IgG 衍生的间隔区与 Fcγ 受体 (FcγR) 相互作用,导致先天免疫反应激活和 CAR-T 细胞耗竭。因此,大多数 IgG 衍生的间隔区都会发生突变,以尽量减少与 FcγR 的相互作用。
除了在 CAR 信号传导中的作用外,铰链区还常用于在工程化后量化和纯化 T 细胞的 CAR 阳性子集。为此,当与 IgG 衍生的间隔区一起使用时,可以使用抗 Fc 抗体。此外,Strep标签序列已成功引入CAR间隔区,以确保更有效地定量和纯化CAR阳性细胞。
跨膜结构域
跨膜结构域将胞外 CAR 结构域锚定到 T 细胞膜上。与 CAR-T 细胞结构的其他模块相比,评估跨膜结构域的重要性和作用的文献要少得多。然而,最近的报告表明,该结构域的结构和组成可以改变表面表达水平并决定所表达的 CAR 的膜稳定性。跨膜结构域已被证明可以控制涉及CAR 组装、激活和聚类的其他关键反应。此外,已知该结构域会影响细胞因子的释放,如果过量,可能会导致高度的非特异性毒性。
作为一般规则,大多数 CAR 包含源自相邻铰链或信号传导结构域的同一蛋白质的跨膜序列。这些结构域大部分源自CD3z、CD4、CD8α 或 CD28,每个结构域都赋予 CAR-T 细胞截然不同的特性。例如,CD3δ衍生的跨膜结构域导致 CAR 掺入内源性 TCR(T 细胞受体)中,这通常伴随着 T 细胞激活的增加和复合物稳定性的降低。相比之下,CD8α 或 CD28 衍生的跨膜结构域显示出增强的膜稳定性。有必要更多地研究这些结构域对 CAR-T 稳定性和疗效的影响。
细胞内信号传导域
胞质内或胞内结构域是受体的功能末端。虽然胞外域(抗原结合域和间隔域)负责引导 T 细胞朝向特定靶点,而跨膜域将 CAR 锚定在膜上,但胞内域的作用是将信号传递至 T 细胞并启动信号级联。
然而,为了有效响应,共刺激信号对于维持级联至关重要。在绝大多数 FDA 批准的 CAR-T 细胞中,主要信号传导结构域通常源自 CD3z,而共刺激结构域(与 CD3z 相邻)源自 CD28 和 4-1BB (CD137)。其他共刺激信号,例如 ICOS、CD27、MYD88 加 CD40 和 OX40 也在临床前试验中证明了功效,但需要更多的研究来确定它们的体内功效。
共刺激结构域还决定T 细胞分化途径、代谢周期、细胞凋亡和激活诱导的细胞死亡。近年来,功能性细胞内信号传导域的研究在科学界中越来越重要,因此,优化其设计策略是确保功效的重要方法。
结束语
尽管 CAR-T 细胞疗法很复杂,但当根据 CAR 的基本结构对其进行分解和分析时,可以更好地理解它们。 CAR 是合成受体,旨在引导 T 细胞到达特定靶点,因此,它们包含一个抗原结合结构域并铰接在细胞外空间、一个负责锚定到细胞膜上的跨膜结构域以及一个旨在触发的内质结构域。信号级联,是 CAR-T 细胞功效的基础。
尽管 CAR-T 细胞设计最近取得了进展,但这些基本结构模块仍然充当构建新疗法的框架。然而,目前CAR-T细胞开发的困难表明需要更好的高通量筛选工具,以确保这些细胞的所有结构成分都得到优化并适应每种特定疾病。
