上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Helixyte Green 双链DNA定量试剂价格 4245
产品规格
产品货号
| Ex (nm) | 502 | Em (nm) | 522 |
| 分子量 | 661.17 | 溶剂 | DMSO |
| 存储条件 | 在零下15度以下保存, 避免光照 |
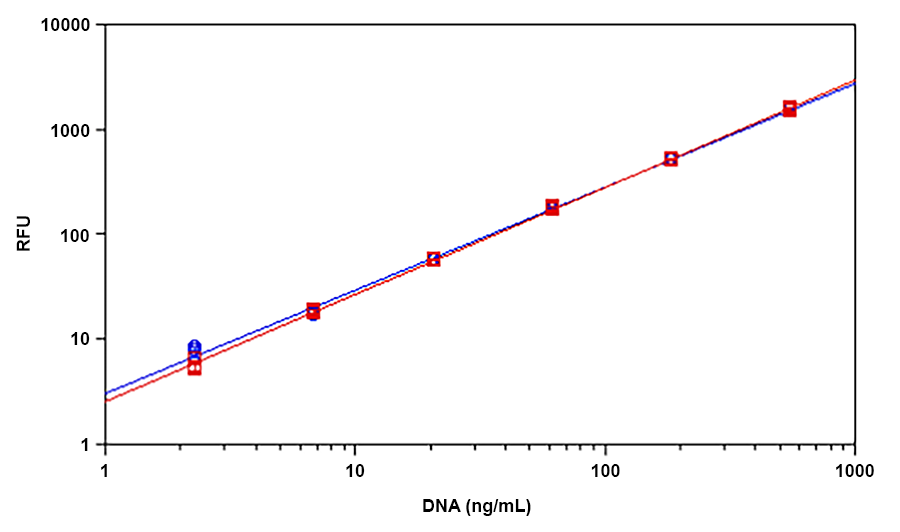
Helixyte Green dsDNA染料是美国AAT Bioquest生产的一种超灵敏荧光核酸染料,用于定量溶液中的双链DNA(dsDNA)。近,Helixyte Green dsDNA染料用于PCR产物的直接循环测序方法中的PCR扩增产量。使用标准光谱荧光计和2.5 ng / mL带有荧光酶标仪的dsDNA检测到少至25 pg / mL的dsDNA(在2 mL测定体积中50 pg dsDNA),在ssDNA,RNA和ss存在下检测效果小 游离核苷酸。该测定在三个数量级上是线性的并且几乎没有序列依赖性。它是从多种来源准确测量DNA的理想选择,包括基因组DNA,病毒DNA,小量制备DNA或PCR。金畔生物是AAT Bioquest的中国代理商,为您提供优质的Helixyte Green 双链DNA定量试剂。
适用仪器
| 荧光酶标仪 | |
| Ex: | 490 nm |
| Em: | 525 nm |
| Cutoff: | 515 nm |
| 推荐孔板: | 纯黑色孔板 |
分析方案
以下方案是使用Helixyte Green 定量dsDNA的实例。 在打开样品瓶之前,让Helixyte Green 温热至室温。
注意:没有数据可用于解决Helixyte Green dsDNA染色的致突变性或毒性。 因为这种试剂与核酸结合,所以应将其作为潜在的诱变剂进行处理,并进行适当的处理。 应特别小心处理DMSO储备溶液,因为已知DMSO有助于有机分子进入组织。
1.准备Helixyte Green 工作解决方案:
1.1通过在TE(10mM Tris-HCl,1mM EDTA,pH 7.5-8.0)中浓缩DMSO溶液200倍稀释,制备Helixyte Green的水性工作溶液。 例如,将50μLHelixyteGreen添加至10 mL TE,以制备足够的工作溶液,以在200μL终体积中测定100个样品。通过用铝箔覆盖或将其置于黑暗中来保护工作溶液免受光照。
注1:我们建议将此溶液用塑料容器而不是玻璃制备,因为染料可能会吸附到玻璃表面。
注2:为获得佳结果,该溶液应在制备后几小时内使用。
2.准备dsDNA标准品的连续稀释液(0至3 ng / mL):
2.1在ddH2O中制备1mg / mL的dsDNA原液(如来自Sigma的小牛胸腺DNA)。
2.2将10μL1mg / mL dsDNA原液(步骤2.1)加入到998 L TE缓冲液中,得到10μg/ mL dsDNA溶液,然后进行1:10和1:2连续稀释,得到1000,100,50,25 ,12.5,6.25,3.125和0 ng / mL。
2.3如说明书中的表1和2中所述,将dsDNA标准品和含有测试样品的DNA添加到96孔固体黑色微孔板中。
3.运行dsDNA测定:
3.1将100μLdsDNA测定混合物(来自步骤1.1)添加至dsDNA标准品的每个孔,空白对照和测试样品(参见步骤2.3)以使总dsDNA测定体积为200μL/孔。
注1:对于384孔板,每孔加入25μL样品和25μLdsDNA测定混合物。
注2:对于基于曲线的测定,每曲线添加1mL样品和1mL dsDNA测定混合物。
3.2在室温下孵育反应5至10分钟,避光。
3.3使用荧光酶标仪在Ex / Em = 490 / 525nm(在515nm处截止)观察荧光增加。
3.4空白孔中的荧光(仅含TE缓冲液)用作对照,并从具有dsDNA反应的那些孔的值中减去。 从DNA标准曲线中产生的标准曲线确定样品的DNA浓度。
参考文献
Inhibitors of Streptococcus pneumoniae surface endonuclease EndA discovered by high-throughput screening using a PicoGreen fluorescence assay
Authors: Peterson EJ, Kireev D, Moon AF, Midon M, Janzen WP, Pingoud A, Pedersen LC, Singleton SF.
Journal: J Biomol Screen (2013): 247
Validation of a PicoGreen-based DNA quantification integrated in an RNA extraction method for two-dimensional and three-dimensional cell cultures
Authors: Chen Y, Sonnaert M, Roberts SJ, Luyten FP, Schrooten J.
Journal: Tissue Eng Part C Methods (2012): 444
Characterization of PicoGreen interaction with dsDNA and the origin of its fluorescence enhancement upon binding
Authors: Dragan AI, Casas-Finet JR, Bishop ES, Strouse RJ, Schenerman MA, Geddes CD.
Journal: Biophys J (2010): 3010
Comparison of SYBR Green I-, PicoGreen-, and [3H]-hypoxanthine-based assays for in vitro antimalarial screening of plants from Nigerian ethnomedicine
Authors: Abiodun OO, Gbotosho GO, Ajaiyeoba EO, Happi CT, Hofer S, Wittlin S, Sowunmi A, Brun R, Oduola AM.
Journal: Parasitol Res (2010): 933
Metal-enhanced PicoGreen fluorescence: application to fast and ultra-sensitive pg/ml DNA quantitation
Authors: Dragan AI, Bishop ES, Casas-Finet JR, Strouse RJ, Schenerman MA, Geddes CD.
Journal: J Immunol Methods (2010): 95
Quantification of dsDNA using the Hitachi F-7000 Fluorescence Spectrophotometer and PicoGreen dye
Authors: Moreno LA, Cox KL.
Journal: J Vis Exp. (2010)
Development and characterization of a novel host cell DNA assay using ultra-sensitive fluorescent nucleic acid stain “PicoGreen”
Authors: Ikeda Y, Iwakiri S, Yoshimori T.
Journal: J Pharm Biomed Anal (2009): 997
Enhanced DNA dynamics due to cationic reagents, topological states of dsDNA and high mobility group box 1 as probed by PicoGreen
Authors: Noothi SK, Kombrabail M, Kundu TK, Krishnamoorthy G, Rao BJ.
Journal: FEBS J (2009): 541
Factors affecting quantification of total DNA by UV spectroscopy and PicoGreen fluorescence
Authors: Holden MJ, Haynes RJ, Rabb SA, Satija N, Yang K, Blasic JR, Jr.
Journal: J Agric Food Chem (2009): 7221
Label-free DNA sequence detection with enhanced sensitivity and selectivity using cationic conjugated polymers and PicoGreen
Authors: Ren X, Xu QH.
Journal: Langmuir (2009): 43
