分子克隆技巧简介
分子克隆是分子生物学中用于组装重组DNA分子的一组实验方法。
基于质粒的克隆包括 4 个主要步骤:
-
插入 DNA 制备
-
载体DNA制备
-
插入片段与载体的连接
-
转化为感受态细胞
在下面的示例中,我们将描述如何使用 SgfI 和 MluI 将目标插入片段亚克隆到载体中。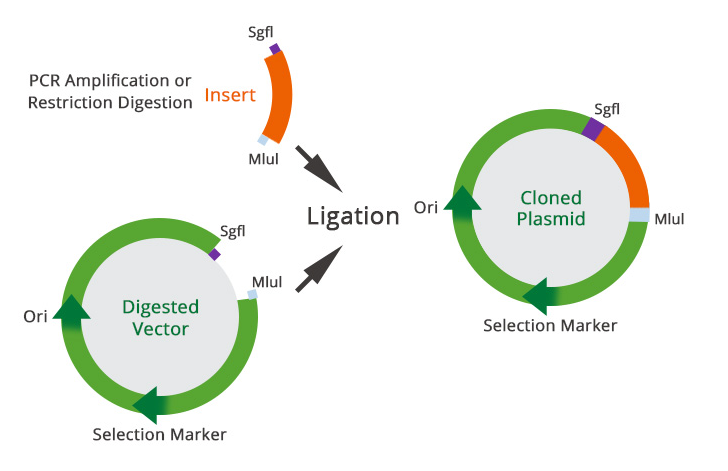
插入 DNA 制备
-
对含有插入片段的载体进行限制性消化
-
用相应的限制性内切酶消化含有插入片段的载体 DNA。对于我们的示例,使用的限制性位点是 SgfI 和 MluI 位点。 OriGene 拥有全基因组 cDNA 表达载体。
-
在琼脂糖凝胶上运行消化的插入 DNA 以检查大小并进行凝胶内纯化。
OTI-TIP:在琼脂糖凝胶上运行纯化的消化插入片段以确认浓度。浓度将进一步有助于建立连接。 -
从模板进行 PCR 扩增
如果无法用兼容的限制性位点切割插入片段,则可以使用 PCR 来扩增插入片段,使其具有目标序列侧翼的所需克隆位点。 -
设计包含目标序列侧翼所需克隆位点的引物。免费的在线软件程序可用于设计引物。如果手动设计,我们建议最小长度约为20bp,GC含量为40-60%,Tm为60-65°C。
-
通过 PCR 扩增模板中的插入 DNA。使用 PCR 纯化试剂盒纯化产物。
-
用限制性内切酶消化 PCR 产物。在琼脂糖凝胶上运行消化的 PCR 并纯化正确大小的 PCR 带。
OTI-TIP:在琼脂糖凝胶上运行纯化的 PCR 插入片段以确认浓度。浓度将进一步有助于建立连接。
载体DNA制备
-
选择适合您的包含多个克隆位点 (MCS) 的克隆载体。 OriGene 拥有超过120 种哺乳动物表达载体,包括病毒和非病毒形式。
如果需要更多的载体DNA,可以使用热休克或电穿孔方法转化至大肠杆菌感受态细胞,例如DH5 alpha。 -
用与插入序列(例如 SgfI 和 MluI 位点)兼容的限制性酶消化 3-5 ug 载体。将限制性消化酶在 37°C 下孵育 1 小时。
OTI-TIP:可能需要更长的孵育时间以确保载体全消化,但不要超过 3 小时。
OTI-TIP:为防止载体自连接,请用碱性磷酸酶在 37°C 下将消化载体的 5' 末端去磷酸化 30 分钟。 -
为了减少未切割的载体质粒背景,我们建议在琼脂糖凝胶上运行消化的载体,然后纯化线性载体。
OTI-TIP:在琼脂糖凝胶上运行纯化的消化载体以确认浓度。浓度将进一步有助于建立连接。
结扎
-
为了成功连接,您可以使用载体:插入片段摩尔比为 1:3。
OTI-TIP: 1:1 和 1:10 之间的载体:插入片段比例也可用于进一步优化连接反应。 -
要确定自连接产生的任何背景克隆,请设置不含插入 DNA 的对照连接。
-
在 16 oC 下孵育过夜(或根据连接试剂盒中的方案)。
转型
-
通过电穿孔或热休克方法将 1-2 uL 连接反应转化至大肠杆菌感受态细胞中。
OTI-TIP:如果插入片段有毒或不稳定,则可以使用专门允许这些插入片段成功扩增的感受态细胞。 -
转移至 SOC 培养基中以复活转化的细胞。在 37°C 下搅拌 SOC 介质 1-2 小时。
-
将混合物接种到装有抗生素平板的 LB 上,并在 37°C 下孵育过夜。
OTI-TIP:对于某些有毒插入物,可能需要较低的温度和较长的孵育时间。较小的菌落可能是正确的克隆。 -
筛选带有目标插入序列的质粒的集落。通过消化、PCR 扩增和测序确认
