借助金纳米粒子、显微 CT 和超声波,绘制活体动物随时间的动脉瘤形成图。
腹主动脉瘤 (AAA) 是一种隐藏的威胁,潜伏在无症状进展的背后。比利时根特大学 bioMMeda 研究小组的 Bram Trachet 博士和他的团队最近研究了预测该疾病的潜在关键。他们使用 AuroVist™(一种用于微型 CT 的无毒 X 射线造影剂),在小鼠模型中创建了随时间推移的主动脉的详细 3D 图像,跟踪动脉瘤的形成。通过超声波扫描计算出的主动脉血流湍流点被发现与后来发生主动脉膨出的区域具有定性相关性。 “我们不能排除血流动力学在 AAA 形成的初始阶段发挥作用,”该小组得出结论。
活体动物主动脉随时间变化的 3D 绘图
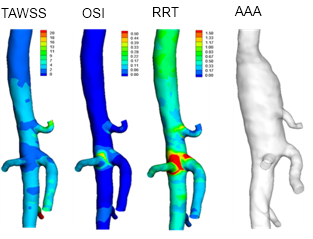
从计算流体动力学获得的时间平均壁剪切应力 (TAWSS)、振荡剪切指数 (OSI) 和相对停留时间 (RRT) 的第 1 天基线计算,与第 31 天右侧动脉瘤发展 (AAA) 的比较。体积渲染来自静脉注射 AuroVist™ 15 nm 后小鼠主动脉的体内显微 CT。
使用基于体内测量的计算流体动力学模拟研究了小鼠主动脉血流动力学(血管内的流动力学)。这是具有挑战性的,因为它需要高分辨率成像来准确绘制动脉的 3 维几何形状,并测量每个点的血流速率。
先前的研究因缺乏小鼠动脉测量所需的体内成像方法而受到限制。 Trachet 和团队通过使用 Nanoprobes 的 AuroVist™ 15 nm 克服了这一问题,该技术可提供无毒性的血管造影,允许“体内血管铸型”,对活体麻醉小鼠的血管系统进行成像,并在研究过程中重复应用。
然后将这些数据与高频超声测量相结合,提供流经腹主动脉的数据集。利用计算流体动力学,研究小组能够绘制出血流紊乱的位置,这可能会对主动脉内皮产生负面影响。
寻找缺失的基线:小鼠模型可以研究“不可检测”的情况
预测腹动脉瘤的一个特殊问题是,在发生灾难性破裂之前,这种情况通常是无症状的。因此,由于基线数据缺失,几乎不可能监测其在人类中的起源和进展。然而,适当的动物模型可以为研究人员提供了解该过程的窗口。
Trachet 和团队使用雄性 ApoE -/- 小鼠模拟了动脉瘤形成,这些小鼠植入了渗透泵,用于在 28 天的时间内输送血管紧张素 II。超声和显微 CT 数据在基线(泵植入前)和末期(泵植入后 31 天)再次采集。对于显微 CT 观察,小鼠静脉注射 100 微升(20 毫克金)Aurovist™-15 nm 金纳米粒子造影剂,然后在 70 kVp 下成像。
计算流体动力学模拟表明,四分之三的小鼠中,血流紊乱的局部区域与诱发的动脉瘤定性一致,尽管进一步的详细分析并不支持这种关系。然而,从这些部分迹象来看,血流动力学仍然是动脉瘤形成的可能预测因素,并且这种关系值得进一步研究。至关重要的是,该小组已经为未来研究这种疾病及其难以捉摸的小鼠发育因素定义了一个实验计算框架,并且对这种疾病的更好理解有一天可能会提供一种方法来识别最有可能罹患这种危及生命的疾病的个体。
将计算增强的可视化引入心血管问题的研究
Trachet 博士和他的同事(Bols,2013)此后在主动脉瘤分析中添加了另一种计算工具,开创了一种计算扫描动脉瘤中存在的初始应力分布的方法,从而解释了扫描几何结构中存在的应力,因为到体内血压。他们再次使用静脉注射 AuroVist™ 15 nm 在小鼠模型中获得 AAA 的高分辨率 3D 图像,并成功执行计算后向位移方法来确定卸载的几何形状,然后将其用于恢复扫描的几何形状,但这一次包括它的初始应力分布。他们的贡献允许基于从体内获得的几何形状对小鼠特定应力进行更正确的计算分析扫描,这可能是更准确地了解心血管疾病病理生理学的重要一步。
“这是一项令人兴奋的工作,” AuroVist™ 制造商 Nanoprobes 的创始人James F. Hainfeld 博士说道。 “它们使我们更加了解动脉瘤的形成;它给了我们希望有一天能及早发现它们。”
