用于DACHPt递送的生物启发透明质酸和聚精氨酸纳米颗粒
用于DACHPt递送的生物启发透明质酸和聚精氨酸纳米颗粒
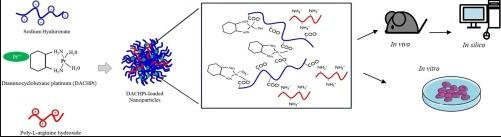
提供了对新型可生物降解聚合物纳米系统的见解,该系统由 透明质酸 和 聚精氨酸 用于二氨基环己烷-铂 (DACHPt) 封装。使用基于离子的温和条件 凝胶化 技术,单分散坯料和DACHPt负载 纳米粒子 (NP)大小约为200 纳米 和负数 ζ潜力 获得(−35 mV)。优化冷冻干燥工艺,提高开发的稳定性和保质期 纳米粒子.重组后,纳米颗粒保持其大小,显示出约70%的缔合效率和高载药量(8%)。 体外 细胞毒性研究表明,负载DACHPt的纳米颗粒具有优越的 抗癌活性 相比 奥沙利铂 溶液。在HT-29电池中,IC50降低了两倍(IC50分别为39μM和74μM),在B6KPC3电池中降低了近1.3倍(分别为18μM和23μM)。而药物和负载DACHPt的纳米颗粒在A549细胞系中的毒性作用相当(IC50 11μM与12μM)。负载DACHPt的纳米颗粒也能够调节免疫原性细胞死亡(ICD) 体外.与B6KPC3细胞孵育后,与ATP释放相关的HMGB1(高迁移率组框1)产生增加。然后 体内药 代 动力学 在静脉注射(IV)加载DACHPt的纳米颗粒和 奥沙利铂 健康小鼠中的溶液(35.9μg铂当量/小鼠)。发现AUC比施用奥沙利铂溶液(3.76小时* mg / L)后获得的值高六倍(24小时* mg / L)。C.max 几乎是对照组的五倍(NP为11.4毫克/升,NP为2.48毫克/升)。此外,分布体积和清除率的减少清楚地表明组织分布更加有限。进行模拟重复静脉注射方案 在计算机中 并且没有显示纳米颗粒中铂的积累。总体而言,所提出的方法公开了一种基于纳米肿瘤学的新型治疗方法 铂金衍生品 具有改善的抗肿瘤活性 体外 和 体内 与游离药物相比的稳定性。
介绍
铂类抗肿瘤药物是应用广泛的抗癌药物之一 用于治疗肺癌、结直肠癌、卵巢癌、头颈部癌、乳腺癌和膀胱癌[1],[2]。顺铂是美国食品和药物管理局(FDA)于1979年批准的第一种化合物[3],对癌症管理产生了深远的影响,现在通常用于肿瘤内科。然而,由于耐药性现象和剂量限制性引起的严重问题阻碍了其临床使用。为了克服这些限制,已经投入了大量精力来开发具有更好毒性特征和改进活性的新型类似物。修饰包括用草酸盐配体作为离去基团和二氨基环己烷(DACH)配体置换 反式-L异构体导致奥沙利铂(反式-L-二氨基环己烷草酸铂(II))。奥沙利铂是一种突出的第三代药物,保留了顺铂的抗肿瘤特性,而没有临床毒性[4]。除DNA损伤外,奥沙利铂还诱导核糖体生物发生应激[5],并通过触发免疫原性细胞死亡(ICD)来帮助产生针对肿瘤的免疫反应[6],[7]。尽管在疗效方面具有这些积极特征,但已有反复奥沙利铂给药周期的神经毒性[8]和肾衰竭病例的报道[9],[10]。
在这种情况下,纳米药物通过降低药物毒性和通过组织或细胞靶向提高治疗效果,有望改善铂类抗癌治疗。到目前为止,已经做出了许多努力来开发捕获奥沙利铂或其衍生物的纳米载体[1],[11],[12],[13],[14],[15]。与非包封药物相比,铂类药物在脂质体中的包封在几种肿瘤模型上显示出更高的抗癌活性[16]。MBP-426是一种携带奥沙利铂并用转铁蛋白装饰的脂质体制剂,目前正处于II.期临床开发阶段,与亚叶酸钙和5-氟尿嘧啶联合用于治疗胃腺癌[17]。还研究了聚合物纳米颗粒(NP)和胶束的铂递送。 由N-(2-羟丙基)甲基丙烯酰胺(HPMA)AP5346(ProLindac®,Access Pharmaceuticals,Inc.)与DACHPt偶联的NP在肿瘤生长抑制和安全性方面显示出优越的活性[18],[19]。Cabral及其同事开发了一种由PEG-b-(聚)谷氨酸组成的共聚胶束,用于顺铂或(1,2-二氨基环己烷)铂(II)(DACHPt)封装[20],[21]。与游离奥沙利铂相比,DACHPt胶束显著延长血液循环,肿瘤组织中蓄积更多[20]。2-二氨基环己烷)铂(II)(DACHPt)封装[20],[21]。与游离奥沙利铂相比,DACHPt胶束显著延长血液循环,肿瘤组织中蓄积更多[20]。2-二氨基环己烷)铂(II)(DACHPt)封装[20],[21]。与游离奥沙利铂相比,DACHPt胶束显著延长血液循环,肿瘤组织中蓄积更多[20]。
基于这一背景,本工作的目的是设计和开发一种由透明质酸(HA)和聚精氨酸(PA)等生物启发聚合物制成的新型NP系统,用于DACHPt封装[22]。选择HA和PA是因为它们具有无毒性、生物降解性和生物相容性[23]。HA是一种阴离子多糖,广泛用于生物医学应用[24],[25],[26]。它是一种糖胺聚糖,也是细胞外基质(ECM)的重要组成部分。此外,它可以特异性识别膜糖蛋白,例如被各种癌细胞过表达的CD44受体[27],[28]。PA是一种阳离子聚氨基酸,由重复28至32个精氨酸部分组成,可被体内肽酶降解,确保高生物相容性[29]。对负载DACHPt的NP进行了优化, 评估物理化学特征及其细胞毒性活性 体外 针对胰腺(B6KPC3),肺癌(A549)和结肠(HT-29)癌细胞系。还评估了DACHPt负载NP通过量化HMGB1(高迁移率组框1)和ATP等警报因子的释放来诱导ICD的能力。还评估了癌细胞对这些纳米系统的摄取机制与CD44表达的相关性。最后, 体内 在健康小鼠静脉内给药(IV)后的药代动力学研究中评估了开发的NP的行为。
